Différence entre l'acide et l'alcalin
Le différence clé entre l'acide et l'alcalin est que Le pH des acides se situe en dessous du pH 7 tandis que le pH de l'alcalin est au-dessus du pH 7.
Les acides et les bases sont deux concepts importants en chimie. Ils ont des propriétés contradictoires. Alcalin est un sous-ensemble de bases. Ainsi, il a toutes les caractéristiques de base. En outre, il existe différentes méthodes pour différencier l'acide et l'alcali dont nous discuterons ci-dessous.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide
3. Qu'est-ce que l'alcalin
4. Comparaison côte à côte - acide vs alcalin sous forme tabulaire
5. Résumé
Qu'est-ce que l'acide?
Il existe plusieurs définitions d'acides de différents scientifiques. Arrhenius définit un acide comme une substance qui donne H3O+ ions dans la solution. Tandis que Bronsted-lowry définit un acide comme une substance qui peut donner un proton. Cependant, la définition de l'acide de Lewis est bien plus courante que les deux ci-dessus. Selon lui, tout accepteur d'électrons est un acide. Selon la définition d'Arrhenius ou de Bronsted-Lowry, un composé, pour le nommer comme un acide, devrait avoir de l'hydrogène et la capacité de le donner comme proton. Mais selon Lewis, il y a des molécules, qui ne possèdent pas d'hydrogène mais peuvent agir comme un acide. Par exemple, bcl3 est un acide Lewis, car il peut accepter une paire d'électrons. L'alcool est un acide brronsted-lowry car il peut donner un proton, mais selon Lewis, c'est une base.

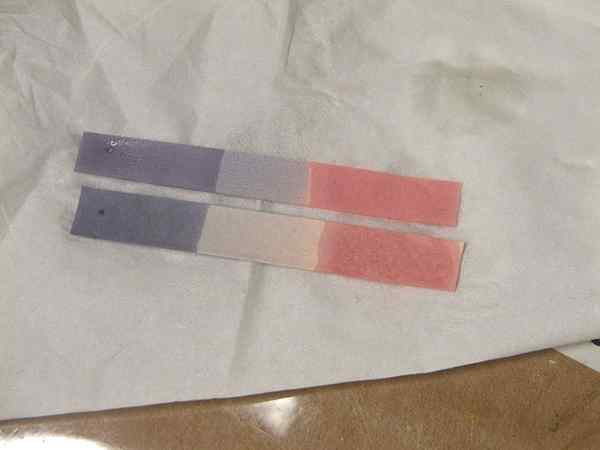
Figure 01: Couleur des décisions décisives pour les acides et les bases
Quelles que soient les définitions ci-dessus, nous identifions normalement un acide comme donneur de protons. Les acides ont un goût aigre. Jus de citron vert, le vinaigre est deux acides que nous rencontrons chez nous chez nous. Ils réagissent avec des bases produisant de l'eau, et ils réagissent également avec les métaux pour former H2, augmentez ainsi le taux de corrosion des métaux. Nous pouvons classer les acides en deux classes, selon leur capacité à dissocier et à produire des protons. Ce sont des acides forts et des acides faibles.
Acides forts et acides faibles
Acides forts comme HCL, HNO3 peut complètement ioniser dans une solution pour donner des protons. Acides faibles comme ch3COOH peut se dissocier partiellement pour donner moins de quantités de protons. Ka est la constante de dissociation acide. Cela donne une indication de la capacité de perdre un proton d'acide faible. Pour vérifier si une substance est un acide ou non, nous pouvons utiliser plusieurs indicateurs comme le papier décisif ou le papier de pH. Dans l'échelle de pH de 1 à 6 acides sont représentés (en dessous du pH 7). Un acide avec pH 1 est un très fort et à mesure que la valeur de pH augmente, l'acidité diminue. De plus, les acides deviennent bleus bleu en rouge.
Qu'est-ce que l'alcalin?
Alcalin a un pH au-dessus de 7. Par conséquent, le pH d'une substance alcaline se situe au-dessus du pH 7. Les éléments du groupe 1 et du groupe 2, que nous nommons sous forme de métaux alcalins et de métaux terrestres alcalins sont des substances alcalines communes, et ils donnent des solutions alcalines lorsque nous les dissolvons dans l'eau. Hydroxyde de sodium, hydroxyde de potassium, hydroxyde de magnésium, carbonate de calcium sont quelques-uns des exemples de ces substances alcalines.
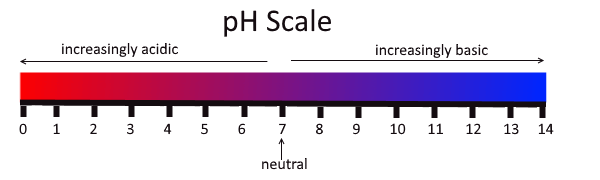
Figure 02: Acides et bases à l'échelle du pH
Arrhenius définit les bases comme les substances qui produisent OH- en solutions. Au-dessus des molécules se forment oh- Lorsque nous les dissolvons dans l'eau, agissez donc comme des bases. Les solutions alcalines réagissent facilement avec les acides produisant des molécules d'eau et de sel. Ils montrent une valeur de pH supérieure à 7 et transforment le tournesol rouge en bleu. Il y a d'autres bases à l'exception des bases alcalines comme NH3. Ils ont également les mêmes propriétés de base.
Quelle est la différence entre l'acide et l'alcalin?
Les acides et alcalins sont deux formes de composés que nous classons en fonction du pH. Par conséquent, la principale différence entre l'acide et l'alcalin est que le pH des acides se situe en dessous du pH 7 tandis que le pH de l'alcalin est au-dessus du pH 7 7. De plus, les acides peuvent ioniser pour former des protons ou H+ Les ions tandis que les composés alcalins peuvent ioniser pour former des ions d'hydroxyde. Lorsque vous envisagez le goût et la texture de ces deux composés, nous pouvons obtenir une autre différence entre les composés acides et alcalins. C'est-à-dire que les acides ont un goût aigre et ont une sensation collante tandis que l'alcalin a un goût amer et a une sensation glissante.
L'infographie ci-dessous résume la différence entre l'acide et l'alcalin sous forme tabulaire.
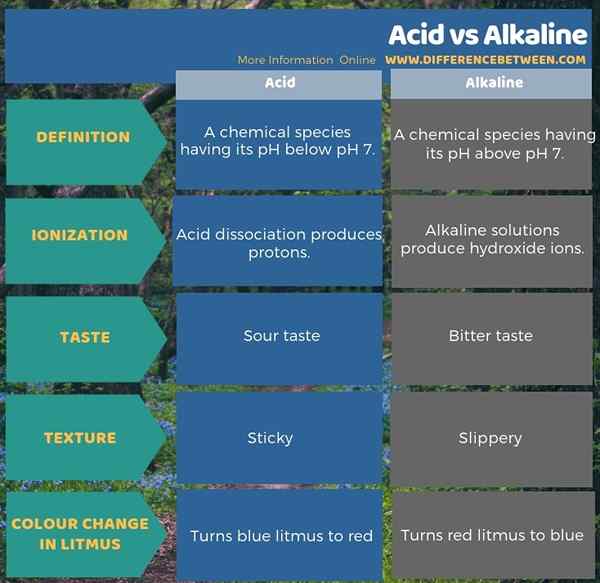
Résumé - Acid vs alcalin
Les acides et les alcalines ont des propriétés chimiques et physiques opposées en raison de leurs différents comportements chimiques. La principale différence entre l'acide et l'alcalin est que le pH des acides est inférieur au pH 7 alors que le pH de l'alcalin est au-dessus du pH 7 7.
Référence:
1. Britannica, les éditeurs de l'Encyclopaedia. "Acide.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 27 décembre. 2017. Disponible ici
2. «Alcalin | Définition de l'alcalin en anglais par les dictionnaires d'Oxford.«Dictionnaires d'Oxford | Anglais, dictionnaires d'Oxford. Disponible ici
Image gracieuseté:
1.«Papier Litmus» par Chemical Interest - Propre travaux, (domaine public) via Commons Wikimedia
2.«PH Scale» de Christinelmiller - Propre travaux, (CC By-SA 4.0) via Commons Wikimedia


