Différence entre l'acétal et l'hémiacétal
Les acétals contiennent deux groupes, un groupe d'un -r et un atome -h. Dans les hémiacétaux, l'un des groupes en acétaux est remplacé par un groupe -OH. C'est le différence clé entre l'acétal et l'hémiacétal.
Les acétaux et les hémiacétaux sont deux groupes fonctionnels qui se trouvent le plus souvent dans les produits naturels. L'hémiacétal est un composé chimique intermédiaire formé pendant le processus chimique de la formation d'acétal. Par conséquent, ces deux groupes ont une légère différence dans leur structure chimique. En détail, l'atome de carbone central dans ces deux composés est un SP3-C atome lié à quatre obligations, et sur ces quatre obligations, un seul type de liaison est différent.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acétal
3. Qu'est-ce que l'hémiacétal
4. Comparaison côte à côte - acétal vs hémiacétal sous forme tabulaire
5. Résumé
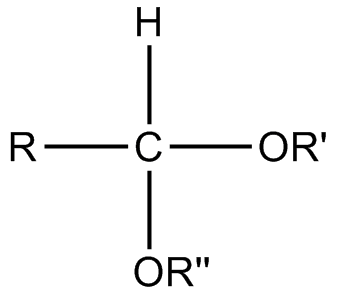
Qu'est-ce que l'acétal?
L'acétal est un groupe fonctionnel où l'atome de carbone central a quatre liaisons; -OU1, -OU2, -R3 et h (où r1, R2 et r3Les groupes sont des fragments organiques). Les deux groupes-ou peuvent être équivalents les uns aux autres (acétaux symétriques) ou différents (acétal mixte).

Figure 1: acétal
L'atome de carbone central serait saturé car il a quatre liaisons et cela fournit à l'atome de carbone central une géométrie tétraédrique. Les acétaux peuvent être formés à partir d'aldéhydes. La formation d'un acétal peut avoir lieu lorsque le groupe hydroxyle d'un hémiacétal est protoné pour perdre une molécule d'eau. Le carbocation résultant est ensuite rapidement attaqué par une molécule d'alcool. Au cours de la dernière étape, la formation d'acétal se termine après avoir reçu un proton de l'alcool. Le mécanisme de formation d'acétals peut être expliqué comme suit.
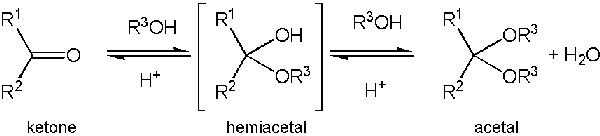
Figure 2: Formation d'acétals
De plus, les acétaux sont utilisés pour protéger les groupes carbonyle dans la synthèse organique car ils sont stables avec de nombreux agents oxydants et réducteurs et en hydrolyse dans le milieu de base.
Exemples
Quelques exemples de composés chimiques contenant des groupes fonctionnels acétaux sont comme ci-dessous.
- Diméthoxyméthane: un solvant
- Dioxolane
- Métaldéhyde
- Paraldéhyde
- La plupart des liaisons glycosidiques dans les glucides et autres polysaccharides sont des liaisons acétales.
- La cellulose est un exemple omniprésent de polyacétal.
- Polyoxyméthylène (POM): un polymère de formaldéhyde qui est utilisé comme plastique.
- Le 1,1-diéthoxyéthane (acétaldéhyde diéthyl acétal), est un agent aromatisant important dans les boissons distillées.
Qu'est-ce que l'hémiacétal?
Les hémiacétaux sont dérivés d'aldéhydes et le terme hémiacétal provient du mot grec "hémi" moyens "moitié".
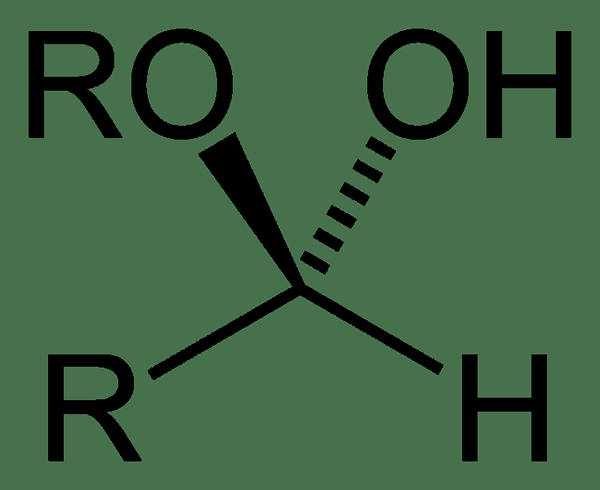
Figure 3: hémiacétal
Les hémiacétaux peuvent être synthétisés en utilisant plusieurs méthodes; par l'ajout nucléophile d'alcool à un aldéhyde, par l'ajout nucléophile d'alcool à un cation hémiacétal stabilisé par résonance et par hydrolyse partielle d'un acétal.
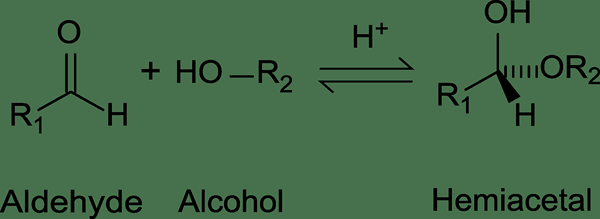
Figure 4: Formation d'hémiacétal
La principale caractéristique structurelle d'une molécule hémiacétale est d'avoir un atome de carbone central avec quatre liaisons différentes; -OU1 groupe, -r2 groupe, groupe -h et groupe -OH.
Exemples
La plupart des hémiacétaux se trouvent comme des groupes fonctionnels communs dans les produits naturels. Certains exemples sont;
- Glucose
- Mycorrhizin a
- Thromboxane b2
Quelle est la différence entre l'acétal et l'hémiacétal?
Le groupe fonctionnel acétal a un SP3 atome de carbone hybridé lié à deux groupes, un atome d'hydrogène et un groupe -r. En revanche, l'atome central des hémiacétaux contiennent un SP3-L'atome c s'est lié à quatre groupes chimiques différents; Ils sont -ou, -r, -oh et -h.
Les acétaux sont chimiquement stables par rapport aux hémiacétaux. Cependant, les acétals hydrolysent facilement à leur alcool parent et au composé carbonyle en présence d'acides aqueux. En général, nous considérons généralement les hémiacétaux comme des composés chimiques instables, par conséquent, ils ont tendance à former des structures en anneau pour augmenter la stabilité. Dans ce cas, la formation d'anneaux de 5 ou 6 membres est possible, ce qui se produit par la réaction entre le groupe -OH avec un groupe carbonyle. Deux exemples d'hémiacétaux cycliques sont le glucose et l'aldose.

Résumé - acétal vs hémiacétal
Les acétals contiennent deux groupes, un groupe d'un -r et un atome -h. Dans les hémiacétaux, l'un des groupes en acétaux est remplacé par un groupe -OH. C'est la différence fondamentale entre l'acétal et l'hémiacétal.
Les références:
1. Acétal. (n.d.). Récupéré le 11 octobre 2016, d'ici.
2. Hémiacétal. (n.d.). Récupéré le 11 octobre 2016, d'ici


