Quelle est la différence entre la cellule voltaïque et les cellules électrolytiques
La principale différence entre la cellule voltaïque et les cellules électrolytiques est qu'une cellule voltaïque utilise l'énergie libérée lors d'une réaction redox spontanée pour produire de l'électricité, tandis qu'une cellule électrolytique utilise l'énergie électrique à partir d'une source externe pour forcer une réaction à se produire.
Les cellules voltaïques ou les cellules galvaniques et les cellules électrolytiques sont deux termes importants en électrochimie. L'électrochimie peut être décrite comme l'étude de la relation entre l'électricité et les réactions chimiques. Il existe deux types de cellules électrochimiques; Ce sont des cellules voltaïques et des cellules électrolytiques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une cellule voltaïque
3. Qu'est-ce qu'une cellule électrolytique
4. Cellule voltaïque vs cellule électrolytique sous forme tabulaire
5. Résumé - cellule voltaïque vs cellule électrolytique
Qu'est-ce qu'une cellule voltaïque?
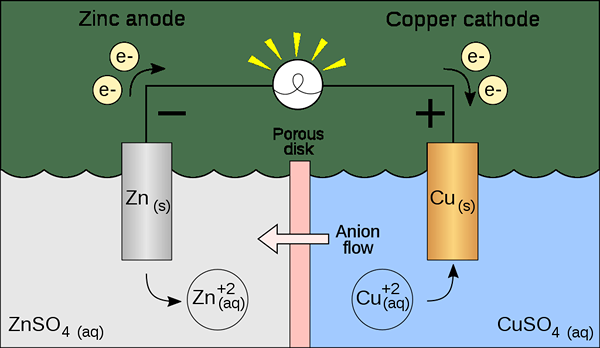
Une cellule voltaïque est un type de cellule électrochimique qui utilise des réactions redox spontanées pour générer de l'énergie électrique. Il est également connu comme un pile galvanique. La cellule contient deux demi-cellules qui peuvent être soit de la même composition ou de différentes compositions. Chaque demi-cellule contient une électrode et un électrolyte. L'électrode doit être immergée dans la solution électrolytique. Parfois, ces électrolytes sont complètement séparés, mais d'autres fois, ils ne sont séparés que par une barrière poreuse. Lorsque les électrolytes sont complètement séparés, nous devons utiliser un pont de sel pour maintenir le mouvement des ions entre les deux électrolytes.

Figure 01: une cellule voltaïque
Lors de la préparation de cette cellule, nous devons déterminer si les électrodes et les électrolytes sont spontanés ou non. Nous pouvons le trouver théoriquement en calculant les potentiels d'électrode de chaque demi-cellule. Cependant, une demi-cellule devrait montrer de l'oxydation, tandis que l'autre demi-cellule devrait montrer une réaction de réduction. L'oxydation se produit à l'anode, tandis que la réduction se produit à la cathode. Puisqu'une cellule galvanique (voltaïque) utilise l'énergie libérée lors d'une réaction redox spontanée pour produire de l'électricité, les cellules galvaniques sont importantes comme source d'énergie électrique. Ils produisent un courant direct.
Qu'est-ce qu'une cellule électrolytique?
Une cellule électrolytique est un dispositif dans lequel l'énergie électrique est convertie en énergie chimique ou vice versa. Ce type de cellule contient généralement deux conducteurs métalliques ou électroniques qui sont maintenus les uns des autres et en contact avec un électrolyte qui est généralement dissous ou fusionné dans des composés ioniques.
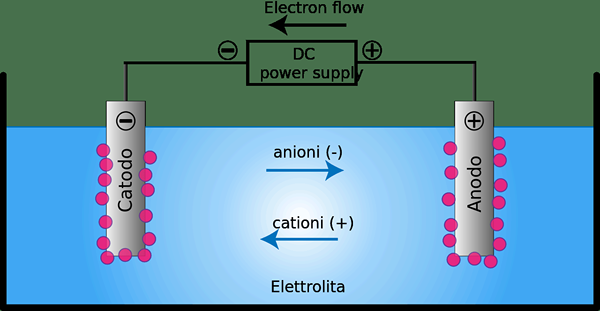
Figure 02: une cellule électrolytique
Nous pouvons utiliser des cellules électrolytiques comme cellules électrochimiques utilisées pour faire en sorte que l'électrolyse se produise dans certains composés. Pour e.g. soumettre l'eau à l'électrolyse peut former de l'oxygène gazeux et de l'hydrogène gazeux. Cet appareil utilise un courant électrique pour générer des réactions redox défavorisées thermodynamiquement. De plus, l'oxydation se produit à l'anode, tandis que la réduction se produit à la cathode.
Quelle est la différence entre la cellule voltaïque et les cellules électrolytiques?
Les termes cellule voltaïque (cellule galvanique) et cellule électrolytique sont très importantes dans la production d'électricité. La principale différence entre la cellule voltaïque et les cellules électrolytiques est qu'une cellule voltaïque utilise l'énergie qui est libérée lors d'une réaction redox spontanée pour produire de l'électricité, tandis qu'une cellule électrolytique utilise l'énergie électrique à partir d'une source externe pour forcer une réaction à se produire pour se produire. Lorsque l'on considère leur libération d'énergie, les cellules voltaïques dérivent l'énergie des réactions redox spontanées, tandis que les cellules électrolytiques impliquent des réactions non spontanées et nécessitent donc des sources d'électrons externes telles que les batteries CC de sources d'alimentation CA.
Le tableau suivant résume la différence entre la cellule voltaïque et les cellules électrolytiques.
Résumé - cellule voltaïque vs cellule électrolytique
Les cellules voltaïques et les cellules électrolytiques sont deux termes importants en électrochimie. La principale différence entre la cellule voltaïque et les cellules électrolytiques est qu'une cellule voltaïque utilise l'énergie qui est libérée lors d'une réaction redox spontanée pour produire de l'électricité, tandis qu'une cellule électrolytique utilise l'énergie électrique à partir d'une source externe pour forcer une réaction à se produire pour se produire.
Référence:
1. «Électrochimie (article)." Académie Khan.
Image gracieuseté:
1. «Cellule galvanique sans flux de cations» par Original: Ohiostandard Vector: Anticompositenumber - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Charge de cellules électrolytiques» de Rodes2 - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


