Quelle est la différence entre le phosphate inorganique (PI) et le pyrophosphate (PPI)
Le Différence clé entre le phosphate inorganique (PI) et le pyrophosphate (PPI) est que les composés de phosphate inorganiques peuvent être trouvés comme un groupe de phosphate attaché aux cations métalliques (s) tandis que les pyrophosphates peuvent être trouvés comme deux groupes de phosphate liés les uns aux autres via une liaison P-O-P et cet anion est associé à des cations métalliques en métal.
Les phosphates sont des composés inorganiques. Il existe différents types de phosphates, notamment des diphosphates, des orthophosphates, des pyrophosphates, etc.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le phosphate inorganique (PI)
3. Qu'est-ce que le pyrophosphate (PPI)
4. Phosphate inorganique (PI) vs pyrophosphate (PPI) sous forme tabulaire
5. Résumé - Phosphate inorganique (PI) vs pyrophosphate (PPI)
Qu'est-ce que le phosphate inorganique (PI)?
Les phosphates inorganiques sont des sels d'acide phosphorique. Dans ces composés, nous pouvons voir un groupe de phosphate attaché à un cation métallique. Par conséquent, le groupe phosphate agit comme un anion. La charge globale de cet anion est de -3. Cela indique que cet anion peut participer à la formation de sels monobasiques, dibasiques et tribasiques. Le groupe phosphate a un arrangement tétraédrique. Les phosphates inorganiques se produisent naturellement comme les sels des éléments du groupe 1. Ex: sodium (NA), potassium (k), calcium (CA), etc.
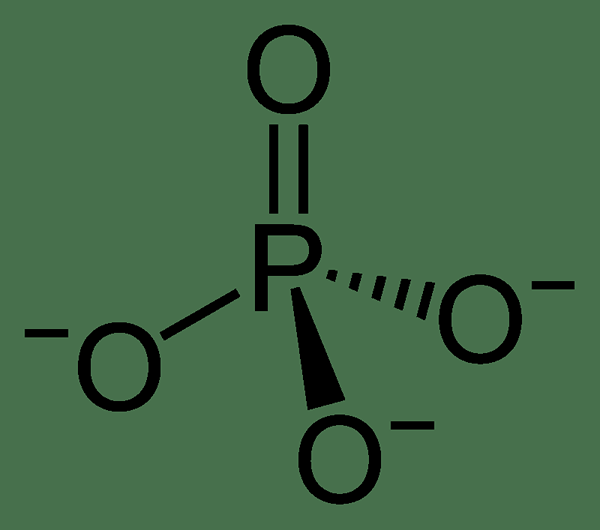
Figure 01: La structure chimique de l'anion phosphate
Les deux principaux composés de phosphate inorganique sont les orthophosphates et les phosphates condensés. Parmi eux, les orthophosphates sont très réactifs, et ce sont les phosphates inorganiques les plus simples. Ils ne contiennent qu'une seule unité de phosphate par molécule. Les phosphates condensés contiennent plus d'une unité de phosphate. Ces composés sont également utiles comme engrais, ex: superphosphate et triple superphosphate.
Qu'est-ce que le pyrophosphate (PPI)?
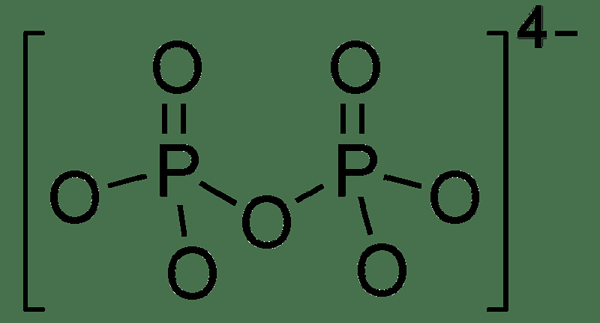
Le pyrophosphate est une oxyanion phosphoreuse composée de deux atomes de phosphore sous forme de liaison P-O-P. Il existe de nombreux sels de pyrophosphate différents, notamment le pyrophosphate de disodium et le tétrasodium pyrophosphate. Nous pouvons également décrire le pyrophosphate comme un diphosphate car il semble que deux groupes de phosphate sont attachés l'un à l'autre. De plus, les molécules de pyrophosphate parent sont dérivées de la neutralisation partielle ou complète de l'acide pyrophosphorique.

Figure 02: La structure chimique du pyrophosphate
Nous pouvons préparer un composé de pyrophosphate en chauffant les phosphates. Cependant, les sels de pyrophosphate sont produits industriellement par l'acide phosphorique dans une mesure où une réaction de condensation a lieu. De plus, ces composés apparaissent généralement en blanc ou sont incolores. Parmi ces sels, les pyrophosphates associés aux métaux alcalins sont des substances solubles dans l'eau. De plus, ces sels sont importants en tant qu'agents complexants pour les ions métalliques. Par conséquent, les pyrophosphates ont de nombreuses applications importantes dans l'industrie chimique.
Quelle est la différence entre le phosphate inorganique (PI) et le pyrophosphate (PPI)?
Les phosphates inorganiques sont des sels d'acide phosphorique. Dans ces composés, nous pouvons voir un groupe de phosphate attaché à un cation métallique. Le pyrophosphate est une oxyanion phosphoreuse composée de deux atomes de phosphore sous forme de liaison P-O-P. La principale différence entre le phosphate inorganique (PI) et le pyrophosphate (PPI) est que les composés de phosphate inorganiques peuvent être trouvés comme un groupe de phosphate attaché à des cations métalliques, tandis que les pyrophosphates peuvent être trouvés comme deux groupes de phosphate liés à travers un P-O-P. Lien et l'anion est associé à des cations métalliques.
Le tableau suivant présente la différence entre le phosphate inorganique (PI) et le pyrophosphate (PPI) plus en détail.
Résumé - Phosphate inorganique (PI) vs pyrophosphate (PPI)
Les phosphates et les pyrophosphates inorganiques sont deux types différents de composés dérivés des phosphates. La principale différence entre le phosphate inorganique (PI) et le pyrophosphate (PPI) est que les composés de phosphate inorganiques peuvent être trouvés comme un groupe de phosphate attaché à des cations métalliques, tandis que les pyrophosphates peuvent être trouvés comme deux groupes de phosphate liés à travers un P-O-P. Lien et l'anion est associé à des cations métalliques.
Référence:
1. Maier, Karyn et al. «Qu'est-ce que le pyrophosphate?" Info Bloom, 27 janvier. 2021.
2. «Pyrophosphate." Un aperçu | Sujets ScienceDirect.
Image gracieuseté:
1. «Phosphat-ion» par Neurotiker ⇌ - Propre travaux (domaine public) via Commons Wikimedia
2. «Pyrophosphate Anion» par Kemikungen - Propre travaux (domaine public) via Commons Wikimedia


