Quelle est la différence entre l'éthyl-nitrite et le nitroéthane
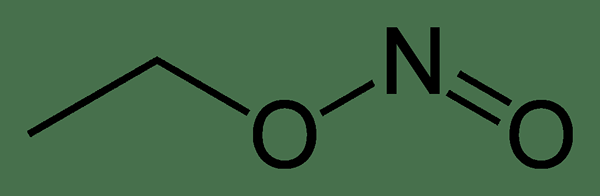
Le différence clé entre l'éthyl nitrite et le nitroéthane est que dans l'éthyl nitrite, un atome d'oxygène est attaché à un atome de carbone, et l'autre atome d'oxygène est attaché à un atome d'azote, tandis que dans le nitroéthane, les deux atomes d'oxygène sont liés à l'atome d'azote.
L'éthyl nitrite et le nitroéthane ont la même formule chimique: C2H5NON2. Ce sont des isomères fonctionnels. Mais il existe plusieurs différences entre l'éthyl nitrite et le nitroéthane.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'éthyl nitrite
3. Qu'est-ce que le nitroéthane
4. Éthyl nitrite vs nitroéthane sous forme tabulaire
5. Résumé - éthyl nitrite vs nitroéthane
Qu'est-ce que l'éthyl nitrite?
L'éthyl nitrite est un type de nitrite alkyle ayant la formule chimique C2H5NON2. Il peut être préparé à partir de l'éthanol. La masse molaire de ce composé est 75.067 g / mol. Il est mal soluble dans l'eau, et son point d'ébullition est de 17 degrés Celsius.

Figure 01: La structure chimique de l'éthyl nitrite
Nous pouvons utiliser de l'éthyl nitrite comme réactif avec la butanone pour produire du diméthylglyoxime comme produit final. Ce composé est l'ingrédient principal d'un remède traditionnel à base d'éthanol (pour le rhume et la toux) nommé Witdulsies, qui a une origine sud-africaine, et c'est un remède contre le froid et la grippe. En Afrique du Sud, il est même vendu en pharmacies. Cependant, il a été interdit d'être vendu au comptoir aux États-Unis (aux États-Unis, il est connu sous le nom de nitrite sucrée, de douceur ou de nitrite) depuis 1980. En effet, il est associé à une méthémoglobinémie mortelle.
Qu'est-ce que le nitroéthane?
Le nitroéthane est un composé organique ayant la formule chimique C2H5NON2, qui est similaire au nitrométhane à bien des égards. La masse molaire de ce composé est 75.067 g / mol. Le nitroéthane se produit comme un liquide huileux aux conditions de température et de pression standard. Cependant, le nitroéthane pur est incolore et a une odeur fruitée. Il est légèrement soluble dans l'eau, et il a un point de fusion très bas (-90 degrés Celsius) et un point d'ébullition élevé (112 degrés Celsius).
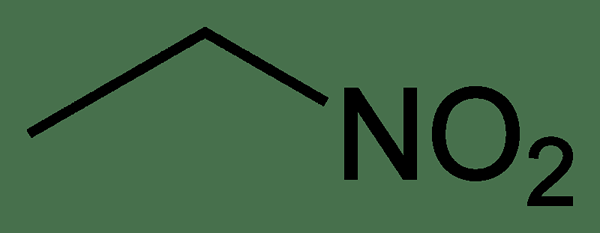
Figure 02: La structure chimique du nitroéthane
Lorsque vous envisagez la préparation du nitroéthane, nous pouvons le produire industriellement en traitant du propane avec de l'acide nitrique à environ 350-450 degrés Celsius. C'est une réaction exothermique. Il donne 4 nitroalcanes importants: nitrométhane, nitroéthane, 1-nitropropane et 2-nitropropane. En outre, cette réaction implique des radicaux libres, y compris le Radical ch3Ch2Ch2O. Ce radical se forme par hémolyse de l'ester nitrite correspondant. Il s'agit d'un radical alcoxy qui est sensible aux réactions de fragmentation C-C. Cela explique la formation du mélange de produits.
Il existe de nombreuses utilisations importantes du nitroéthane, y compris la conversion en autres produits pendant la réaction Henry, la condensation pour donner de l'oxazoline, en tant qu'additif de carburant et comme précurseur des propulseurs de fusée, etc.
Quelle est la différence entre l'éthyl-nitrite et le nitroéthane?
La principale différence entre l'éthyl-nitrite et le nitroéthane est que dans l'éthyl nitrite, un atome d'oxygène est attaché à un atome de carbone tandis que l'autre atome d'oxygène est attaché à un atome d'azote, tandis que dans le nitroéthane, les deux atomes d'oxygène sont liés à l'atome azote. De plus, de l'éthyl nitrite apparaît comme un liquide sans molle clair à jaune, tandis que le nitroéthane est un liquide huileux.
L'infographie ci-dessous présente les différences entre l'éthyl nitrite et le nitroéthane sous forme tabulaire pour une comparaison côte à côte.
Résumé - éthyl nitrite vs nitroéthane
L'éthyl nitrite et le nitroéthane sont deux composés chimiques avec la même formule chimique. Mais la principale différence entre l'éthyl nitrite et le nitroéthane est leur structure chimique; L'éthyl nitrite a un atome d'oxygène attaché à un atome de carbone et un atome d'oxygène attaché à un atome d'azote, mais le nitroéthane a les deux atomes d'oxygène liés à un atome d'azote.
Référence:
1. «Nitrite d'éthyle." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine.
Image gracieuseté:
1. «Ethyl-nitrite-2d-skeletal» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia
2. «Nitroethane-2d-skeletal» par Benjah-BMM27 - propre travail (domaine public) via Commons Wikimedia


