Quelle est la différence entre le modèle Bohr et Schrodinger
Le Différence clé entre le modèle Bohr et Schrodinger est que dans le modèle Bohr, les électrons sont des particules qui n'occupent que certaines orbites d'énergie fixe autour du noyau, tandis que dans le modèle de Schrodinger, les électrons se comportent comme des ondes permanentes ayant une plus grande probabilité d'être dans certaines zones d'espace par rapport à d'autres.
Le modèle Bohr et le modèle Schrodinger sont des modèles très importants en chimie car ils décrivent la structure chimique des atomes et l'emplacement des électrons à un moment donné.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le modèle Bohr
3. Quel est le modèle Schrodinger
4. Modèle bohr vs schrodinger sous forme tabulaire
5. Résumé - modèle Bohr vs Schrodinger
Qu'est-ce que le modèle Bohr?
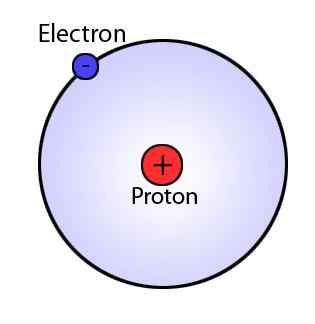
Le modèle Bohr, qui est une modification du modèle Rutherford, explique la structure de l'atome composée d'un noyau entouré d'électrons. Cependant, le modèle Bohr est très avancé que le modèle Rutherford car il suggère que les électrons se déplacent toujours dans des coquilles ou des orbites spécifiques autour du noyau. Ce modèle indique également que ces coquilles ont des énergies différentes et sont de forme sphérique. Ce phénomène a été suggéré par des observations des spectres de ligne pour l'atome d'hydrogène.
Puisqu'il y a des lignes discrètes dans les spectres de ligne, Bohr a déclaré que les orbitales d'un atome ont des énergies fixes et que les électrons peuvent passer d'un niveau d'énergie à l'autre d'énergie émettant ou absorbant, résultant en une ligne dans les spectres de ligne.

Figure 01: modèle Bohr
Postulates principaux du modèle Bohr
- Les électrons se déplacent autour du noyau dans les orbitales sphériques, qui ont une taille fixe et une énergie.
- Chaque orbite a un rayon différent et est nommé du noyau à l'extérieur comme n = 1, 2, 3, etc., ou n = k, l, m, etc., où n est le numéro de niveau d'énergie fixe.
- L'énergie d'une orbitale est liée à sa taille.
- La plus petite orbite a la plus faible énergie. L'atome est complètement stable lorsque les électrons sont au niveau d'énergie le plus bas.
- Lorsqu'un électron se déplace dans une certaine orbitale, l'énergie de cet électron est constante.
- Les électrons peuvent passer d'un niveau d'énergie à un autre en absorbant ou en libérant de l'énergie.
- Ce mouvement provoque des rayonnements.
Généralement, le modèle de Bohr s'adapte parfaitement à l'atome d'hydrogène, qui a un seul électron et un petit noyau chargé positivement. En dehors de cela, Bohr a utilisé la constante de la planche pour calculer l'énergie des niveaux d'énergie de l'atome.
Mais il y a eu quelques inconvénients du modèle Bohr lorsqu'ils expliquent la structure atomique des atomes autres que l'hydrogène.
Limites du modèle Bohr
- Le modèle Bohr n'a pas pu expliquer l'effet Zeeman (effet du champ magnétique sur le spectre atomique).
- Il n'a pas pu expliquer l'effet brut (effet du champ électrique sur le spectre atomique).
- Le modèle Bohr ne parvient pas à expliquer les spectres atomiques des atomes plus grands.
Quel est le modèle Schrodinger?
Le modèle Schrodinger est un modèle de chimie qui suppose qu'un électron est une vague. Ce modèle décrit les régions de l'espace ou des orbitales comme des emplacements où les électrons sont les plus susceptibles de se produire. Ceci est un modèle puissant de l'atome qui a été développé par Erwin Schrodinger en 1926. Il a combiné les équations du comportement des vagues et de l'équation de Broglie afin de créer un modèle mathématique pour décrire la distribution des électrons dans un atome.

Figure 02: Fonction d'onde décrite par Schrodinger
Le principal avantage du modèle Schrodinger est qu'il contient des équations mathématiques appelées fonctions d'onde, qui peuvent satisfaire la nécessité de places sur le comportement des électrons. Cependant, il peut être difficile d'imaginer un modèle physique pour les électrons sous forme de vagues. Plutôt que d'essayer de dire où se trouve l'électron à tout moment, ce modèle décrit la probabilité qu'un électron se retrouve dans une région d'espace donnée à un moment donné.
Quelle est la différence entre le modèle Bohr et Schrodinger?
Le modèle Bohr et le modèle Schrodinger sont comme les bases de la chimie générale. La principale différence entre le modèle Bohr et Schrodinger est que dans le modèle Bohr, les électrons sont des particules qui n'occupent que certaines orbites d'énergie fixe autour du noyau, tandis que, dans le modèle de Schrodinger, les électrons se comportent comme des ondes permanentes ayant une plus grande probabilité d'être dans certains zones d'espace par rapport aux autres.
Vous trouverez ci-dessous un résumé de la différence entre le modèle Bohr et Schrodinger sous forme tabulaire pour une comparaison côte à côte.
Résumé - modèle Bohr vs Schrodinger
Le modèle Bohr et le modèle Schrodinger décrivent la structure chimique des atomes et l'emplacement des électrons à un moment donné. La principale différence entre le modèle Bohr et Schrodinger est que dans le modèle Bohr, les électrons sont des particules qui n'occupent que certaines orbites d'énergie fixe autour du noyau, tandis que, dans le modèle de Schrodinger, les électrons se comportent comme des ondes permanentes ayant une plus grande probabilité d'être dans certains zones d'espace par rapport aux autres.
Référence:
1. «Modèle Schrodinger." Erwin Schrodinger, Éducation à Purdue.
Image gracieuseté:
1. «Bohr Model» par Jia.Liu - propre travail (domaine public) via Commons Wikimedia
2. «Wavepacket-a2k4-en» par xcodexif - propre travail (cc by-sa 4.0) via Commons Wikimedia


