Différence entre l'acide faible et l'acide dilué
Le différence clé entre l'acide faible et l'acide dilué est que L'acide faible est un composé qui se dissocie partiellement lorsqu'il est dissous dans l'eau, tandis que l'acide dilué est une solution contenant plus d'eau que d'acide.
Un acide est un composé qui peut se dissocier dans l'eau pour libérer des protons (ions hydrogène). Par conséquent, les acides ont un pH inférieur à 7. Il existe deux types d'acides comme acides forts et acides faibles en fonction de la force acide. Mais selon la concentration de l'acide, il existe deux types de solutions d'acide en tant qu'acide concentré et acide dilué.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'acide faible
3. Qu'est-ce que l'acide dilué
4. Comparaison côte à côte - acide faible vs acide dilué sous forme tabulaire
5. Résumé
Qu'est-ce qu'un acide faible?
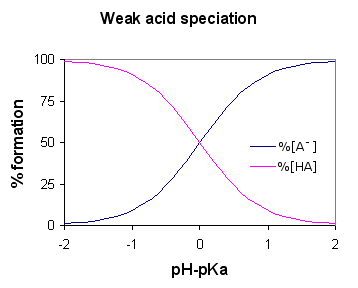
Un acide faible est un composé qui se dissocie partiellement en ses ions lorsqu'il est dissous dans l'eau. Une aide faible est l'acide conjugué d'une base faible. De plus, un acide faible a une valeur de pH élevée par rapport à une forte aide de la même concentration. Lors de l'écriture de l'équation chimique pour la dissociation d'un acide faible, nous utilisons une double flèche pour inclure des réactions vers l'avant et vers l'arrière car la dissociation d'un acide faible est réversible.

Figure 01: Spéciation d'un acide faible (AH est l'acide faible)
Un acide faible devient faible en raison de la nature moins polaire du composé acide; Si le composé est plus polaire, les protons peuvent facilement quitter la molécule acide, mais ici, puisque le composé est moins polaire, il est difficile de décomposer les liaisons chimiques. Certains exemples d'acides faibles incluent l'acide acétique, l'acide formique, l'acide HF, le sulfure d'hydrogène, etc.
Qu'est-ce qu'un acide dilué?
L'acide dilué est une solution aqueuse ayant une faible concentration d'acide. Cela signifie; La solution d'acide diluée a plus d'eau par rapport à la teneur en acide. L'acide dilué peut être un acide faible ou un acide fort. Le terme «dilué» ne décrit uniquement la concentration de l'acide. L'opposé de l'acide dilué est de l'acide concentré.

Figure 02: acide HCl concentré
De plus, nous pouvons diluer un acide en ajoutant plus d'eau. Cependant, l'ajout d'eau à un acide concentré est dangereux. Par conséquent, la méthode sûre consiste à ajouter de l'acide à l'eau. Les acides de dilution sont très importants car l'utilisation d'acides hautement concentrés peut provoquer des brûlures graves si elle touche la peau.
Quelle est la différence entre l'acide faible et l'acide dilué?
L'acide faible relève de la classification des acides en fonction de la force acide, tandis que l'acide dilué relève de la catégorie de concentration d'acides. La principale différence entre l'acide faible et l'acide dilué est que l'acide faible est un composé qui se dissocie partiellement lorsqu'il est dissous dans l'eau, tandis que l'acide dilué est une solution contenant plus d'eau que d'acide. Cependant, la dilution de l'acide n'affecte pas la réactivité de l'acide. Cela signifie qu'un acide fort ne devient pas un acide faible lors de la dilution. Mais, les acides faibles sont moins réactifs par nature.
En dessous de l'infographie résume la différence entre l'acide faible et l'acide dilué.

Résumé - Acide faible vs acide dilué
L'acide faible relève de la classification des acides en fonction de la force acide, et l'acide dilué relève de la catégorie de concentration d'acides. La principale différence entre l'acide faible et l'acide dilué est que l'acide faible est un composé qui se dissocie partiellement lorsqu'il est dissous dans l'eau, tandis que l'acide dilué est une solution contenant plus d'eau que d'acide.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'acide faible et exemples en chimie."Thoughtco, mai. 5, 2019, Commons Wikimedia.
Image gracieuseté:
1. «Spéciation d'acide faible» par P. Gans, propre dessin, le téléchargeur était des Petergans à EN.wikipedia - transféré de en.Wikipedia à Commons par Leaw (domaine public) via Commons Wikimedia
2. «Acide chlorhydrique 05» (domaine public) via Commons Wikimedia


