Différence entre le phosphate de sodium monobasique et dibasique

Phosphate de sodium monobasique vs dibasic | Phosphate de sodium Dibasic vs Phosphate de sodium monobasique | Phosphate de monosodium vs phosphate de disodium | Monosodium vs Phosphate de disodium
Un atome de phosphore est lié à quatre oxygènes, pour former un anion polyatomique -3. En raison des liaisons uniques et de la double liaison, entre P et O, le phosphore a un état d'oxydation de +5 ici. Il a une géométrie tétraédrique. Voici la structure de l'anion phosphate.
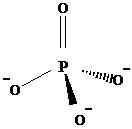
Pote43-
L'anion phosphate peut se combiner avec différents cations, pour former de nombreux composés ioniques. Le phosphate de sodium est un sel comme celui où trois ions sodium sont liés électrostatistiquement avec un anion phosphate. Le phosphate de trisodium est un cristal de couleur blanche, qui se dissout fortement dans l'eau. Lorsqu'il est soluble dans l'eau, il produit une solution alcaline. Le phosphate de sodium monobasique et le phosphate de sodium dibasic sont deux autres composés de sodium et de phosphate. Pour un acide, nous définissons le terme monobasique comme «un acide, qui ne possède qu'un seul proton qui peut être donné à une base lors d'une réaction de base d'acide."De même, le dibasic pour un acide signifie avoir deux protons, qui peuvent être donnés à une base. Mais quand on considère ces deux termes concernant un sel, la signification est complètement différente. Un sel monobasique fait référence à un sel, qui n'a qu'un seul atome d'un métal univalent. Et le sel dibasique signifie avoir deux ions métalliques univalents. Dans ce cas, l'ion métal univalent est le cation sodium. Comme ce sont des sels, ils se dissolvent facilement dans l'eau et produisent des solutions alcalines. Ces composés sont disponibles dans le commerce sous des formes hydrates et anhydres. Le phosphate de sodium monobasique et dibasique ensemble est très important dans les systèmes biologiques comme tampon. De plus, médicalement, ces deux sont utilisés comme laxatif salin, pour traiter la constipation.
Phosphate de sodium monobasique
Phosphate de sodium monobasique ou monosodium phosphate a la formule moléculaire de NAH2Pote4. La masse molaire du composé est de 120 g mol-1. L'anion dans cette molécule n'est pas l'anion trivalent du phosphate, mais le H2Pote4- anion. Cet anion a dérivé de l'ion phosphate où deux hydrogènes sont liés à deux oxygènes négatifs. Alternativement, de l'autre côté, il a dérivé de l'élimination d'un proton de l'acide phosphorique (H3Pote4). L'anion phosphate et h2Pote4- les anions sont en équilibre, dans des milieux aqueux. Le phosphate de sodium monobasique est disponible sous forme de cristaux incolores ou de poudre blanche. Il se dissout facilement dans l'eau, mais ne se dissout pas dans des solvants biologiques comme l'alcool. Le PKA de ceci est compris entre 6.8-7.20. Ce composé peut être fait lorsque l'acide phosphorique réagit avec un sel de sodium comme un halogénure de sodium.
Phosphate de sodium dibasique
Ce composé est également connu sous le nom de phosphate de disodium et a la formule moléculaire de Na2HPO4. La masse molaire du composé est de 142 g mol-1. Lorsque deux cations de sodium remplacent les atomes d'hydrogène dans l'acide phosphorique, le dibasique phosphate de sodium est obtenu. Ainsi, en laboratoire, nous pouvons faire ce composé en réagissant à deux équivalents d'hydroxyde de sodium avec un équivalent d'acide phosphorique. Le composé est un solide cristallin blanc, et il se dissout facilement dans l'eau. Le pH de cette solution aqueuse est une valeur de base, qui se situe entre 8 et 11. Ce sel est utilisé à des fins de cuisson et comme un laxatif.
| Quelle est la différence entre Phosphate de sodium monobasique et phosphate de sodium dibasique? • Le phosphate de sodium monobasique a la formule chimique de NAH2Pote4, et le dibasic phosphate de sodium a la formule chimique de Na2HPO4. • Le poids moléculaire du dibasique de phosphate de sodium est plus élevé que celui du phosphate de sodium monobasique. • Lorsque le phosphate de sodium dibasique se dissout dans l'eau, la basicité est plus élevée dans le milieu que lorsque le phosphate de sodium est dissout dans l'eau. |


