Différence entre le chlorure de sodium et le nitrate de sodium

Le différence clé entre le chlorure de sodium et le nitrate de sodium est que Le chlorure de sodium est une combinaison de cation sodium et d'anion chlorure tandis que le nitrate de sodium est une combinaison d'un cation sodium et d'un anion nitrate.
Le chlorure de sodium et le nitrate de sodium sont des composés ioniques. Ils ont un cation et un anion combiné à travers un lien ionique. Ils ont des propriétés chimiques et physiques différentes car ils ont des anions différents combinés avec des cations similaires (cations sodium).
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorure de sodium
3. Qu'est-ce que le nitrate de sodium
4. Comparaison côte à côte - chlorure de sodium vs nitrate de sodium sous forme tabulaire
5. Résumé
Qu'est-ce que le chlorure de sodium?
Le chlorure de sodium est un composé inorganique en cation sodium et en chlorure d'anion. La formule chimique de ce composé est NaCl. En commun, c'est le «sel» car le sel que nous consommons en tant qu'additif alimentaire contient principalement du chlorure de sodium avec certains composés de traces tels que le chlorure de magnésium.
Le chlorure de sodium est un composé ionique. Il a des ions sodium 1: 1 et des ions de chlorure. Le chlorure de sodium est le composé responsable du goût caractéristique de l'eau de mer. Le poids de la formule du chlorure de sodium est de 58.44 g / mol. Le chlorure de sodium est blanc quand il est pur. Il apparaît comme des cristaux cubiques transparents ou translucides. Le point de fusion du chlorure de sodium est 801oC, tandis que le point d'ébullition est 1465oC. Il est bien soluble dans l'eau. Dans la structure cristalline du chlorure de sodium, chaque ion est entouré de six ions de charge opposée. Ces ions sont situés dans une structure octaèdre régulière.
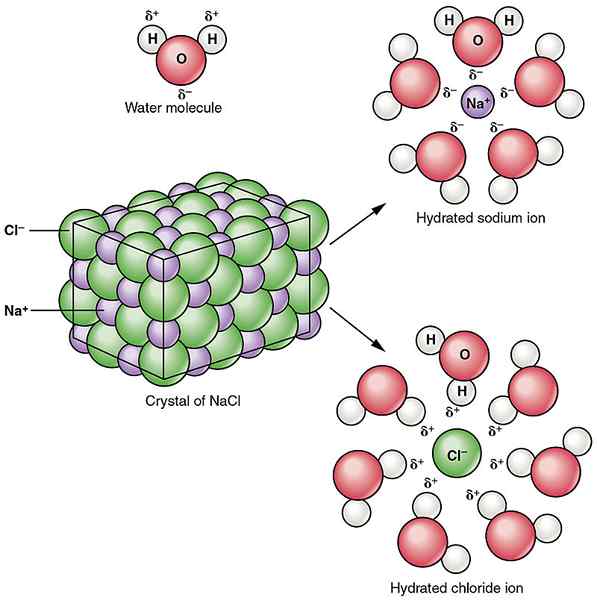
Figure 01: Dissociation du chlorure de sodium dans l'eau
Le chlorure de sodium est hygroscopique. Cela signifie qu'il peut absorber la vapeur d'eau de l'air lorsqu'il est exposé à l'atmosphère. D'ailleurs, ce composé est essentiel pour nous de maintenir l'équilibre électrolytique dans notre corps. Il est également utilisé pour préserver certains aliments.
Qu'est-ce que le nitrate de sodium?
Le nitrate de sodium est un composé inorganique ayant un cation sodium et un anion nitrate. Il a la formule chimique nano3. Il apparaît comme un solide cristallin sans couleur blanc. Il s'agit d'un sel de nitrate de métal alcali. Ce composé est très soluble dans l'eau. Lors de la dissolution, il forme des cations de sodium et des anions de nitrate. Par conséquent, il est utile comme source disponible facilement sur les nitrates dans différents processus de synthèse, production d'engrais, etc.

Figure 02: cristaux de nitrate de sodium
La masse molaire de nitrate de sodium est 84.9 g / mol. Il a une odeur douce. En plus de l'extraction des dépôts, nous pouvons également synthèser. Là, nous pouvons neutraliser l'acide nitrique avec du carbonate de sodium ou du bicarbonate de sodium. Il est également possible de faire cette neutralisation à l'aide d'hydroxyde de sodium. La structure cristalline de ce nitrate de sodium produit peut être définie comme une structure cristalline trigonale, mais parfois, elle donne une structure cristalline rhomboédrique.
Quelle est la différence entre le chlorure de sodium et le nitrate de sodium?
La principale différence entre le chlorure de sodium et le nitrate de sodium est que le chlorure de sodium est une combinaison de cation sodium et d'anion chlorure, tandis que le nitrate de sodium est une combinaison d'un cation sodium et d'un anion nitrate. La formule chimique du chlorure de sodium est NaCl tandis que la formule chimique du nitrate de sodium est nano3.
L'infographie suivante résume la différence entre le chlorure de sodium et le nitrate de sodium.

Résumé - chlorure de sodium vs nitrate de sodium
Le chlorure de sodium et le nitrate de sodium sont des composés ioniques. La principale différence entre le chlorure de sodium et le nitrate de sodium est que le chlorure de sodium est une combinaison de cation sodium et d'anion chlorure tandis que le nitrate de sodium est une combinaison d'un cation sodium et d'un anion nitrate.
Référence:
1. Helmenstine, Anne Marie. «Qu'est-ce que le sel de table?"Thoughtco, février. 11, 2020, disponible ici.
2. Helmenstine, Anne Marie. «Comment faire pousser des cristaux de nitrate de sodium."Thoughtco, février. 11, 2020, disponible ici.
3. "Nitrate de sodium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
4. "Chlorure de sodium.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine, disponible ici.
Image gracieuseté:
1. «214 Dissociation du chlorure de sodium dans Water-01» par OpenStax College - Anatomy & Physiology, Connexions Web Site, 19 juin 2013 (CC par 3.0) via Commons Wikimedia
2. «Cristaux de nitrate de sodium» par Vadim Sedov - propre travail (CC par 4.0) via Commons Wikimedia


