Différence entre les liaisons saturées et insaturées
Le différence clé entre les liaisons saturées et insaturées est que Une liaison saturée n'a pas de liaisons Pi tandis que les liaisons insaturées ont toujours des liaisons PI.
Les liaisons chimiques sont les liens entre les atomes. Ces liaisons provoquent la formation de molécules. Il existe deux principaux types d'obligations; Ce sont les liaisons covalentes et les liaisons ioniques. Cependant, les obligations en métaux sont des obligations métalliques. Les liaisons covalentes se forment lorsque deux atomes partagent leurs électrons de valence. Ces liaisons covalentes peuvent être saturées ou insaturées en fonction du nombre et du type de liaison existant entre deux atomes.
CONTENU
1. Aperçu et différence clé
2. Que sont les liaisons saturées
3. Que sont les obligations insaturées
4. Comparaison côte à côte - liaisons saturées vs insaturées sous forme tabulaire
5. Résumé
Que sont les liaisons saturées?
Les liaisons saturées sont des liaisons uniques. Ce sont des liaisons chimiques covalentes. Là, deux atomes se lient entre eux via une liaison sigma, et donc, il n'y a pas de liaisons Pi - les formes de liaison impliquant deux électrons; un électron de chacun des deux atomes qui forment cette liaison. Ces électrons sont les électrons de valence des atomes. La force de liaison de ce type de liaison est relativement faible. Les deux électrons partagés existent entre les atomes, et l'atome plus électronégatif attirera les électrons vers lui-même.
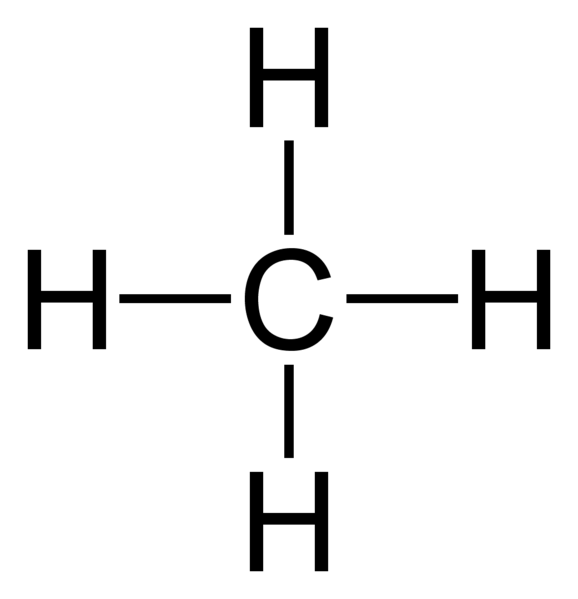
Figure 01: Le méthane est un composé saturé car il a quatre liaisons saturées
De plus, ce type de liaison a la capacité de subir des rotations. Là, cette obligation agit comme l'axe de rotation. Une formes de liaison saturée lorsque les orbitales suivent se chevauchent.
- Deux orbitales S
- Deux pz orbitales
- S et Pz orbital
- Deux Dz2 orbitales
- Chevauchement linéaire des orbitales hybrides.
Que sont les obligations insaturées?
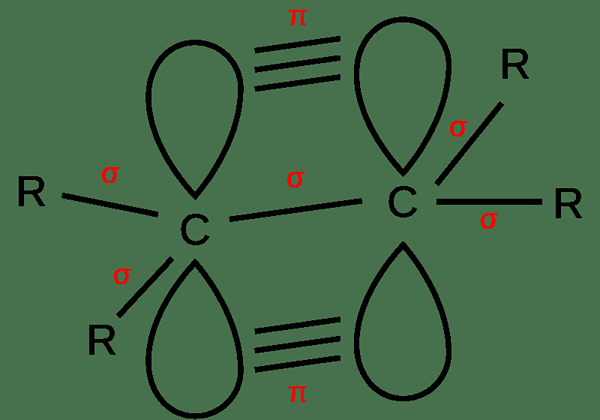
Les liaisons insaturées sont des liaisons doubles et des liaisons triples entre deux atomes. Ce sont des liaisons covalentes. Par conséquent, les électrons sont partagés entre les atomes. De plus, il y a aussi des obligations Sigma et des obligations PI. Dans une double liaison, il y a une liaison sigma et une liaison Pi entre deux atomes. Dans une triple caution, il y a une obligation Sigma et deux obligations PI. Une liaison Sigma se forme due à un chevauchement linéaire des orbitales atomiques tandis que les liaisons Pi se forment dues à un chevauchement parallèle.

Figure 02: Formation d'une double liaison
De plus, une double liaison a quatre électrons de liaison entre les atomes tandis que la triple liaison a six électrons là-bas. En raison de ce grand nombre d'électrons entre les atomes dans des liaisons insaturées, ces liaisons ont tendance à être plus réactives. De plus, ces obligations sont plus fortes et plus courtes par rapport aux obligations uniques.
Quelle est la différence entre les liaisons saturées et insaturées?
Les liaisons saturées sont des liaisons simples et les liaisons insaturées sont des liaisons doubles et des liaisons triples entre deux atomes. La principale différence entre les liaisons saturées et insaturées est qu'une liaison saturée n'a pas de liaisons Pi tandis que les liaisons insaturées ont toujours des liaisons PI. Une autre différence entre les liaisons saturées et insaturées est qu'il y a une paire d'électrons entre deux atomes dans une liaison saturée tandis qu'il y a deux ou trois paires d'électrons entre les atomes dans les liaisons insaturées.
De plus, une différence importante entre les liaisons saturées et insaturées est que les liaisons saturées sont relativement faibles, longues et moins réactives, tandis que les liaisons insaturées sont fortes, courtes et plus réactives. De plus, les liaisons saturées peuvent subir des rotations tandis que les liaisons insaturées ne peuvent pas.
L'infographie ci-dessous est un résumé de comparaison sur la différence entre les liaisons saturées et insaturées.
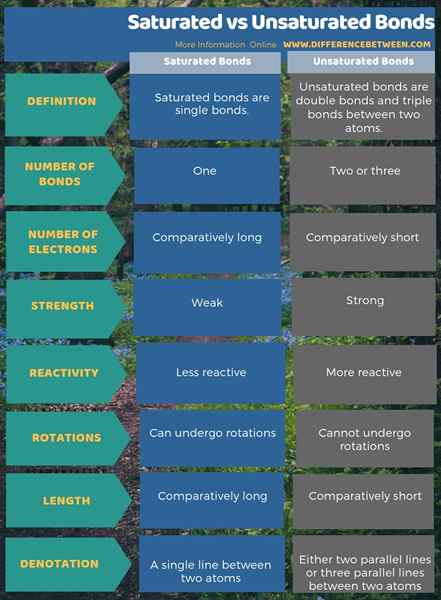
Résumé - Liais sa saturation vs insaturés
En résumé, les liaisons saturées sont des liaisons covalentes simples tandis que les liaisons insaturées sont des liaisons doubles et triples. Par conséquent, la principale différence entre les liaisons saturées et insaturées est qu'une liaison saturée n'a pas de liaisons Pi tandis que les liaisons insaturées ont toujours des liaisons PI.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition à double liaison et exemples en chimie.”Thoughtco, sept. 8, 2017. Disponible ici
2. Britannica, les éditeurs de l'Encyclopaedia. «Triple Bond.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14 avril. 2011. Disponible ici
Image gracieuseté:
1.«Méthane-2d-carré» (domaine public) via Commons Wikimedia
2.«Double-Bond» par Fred the Oysteri (CC BY-SA 4.0) via Commons Wikimedia


