Différence entre le sel rocheux et le chlorure de calcium

Le différence clé entre le sel rocheux et le chlorure de calcium est que En tant qu'agents de désinfusion, le chlorure de calcium est très efficace à des températures plus basses que l'efficacité du sel de roche à la même température à basse température.
Le sel rocheux et le chlorure de calcium sont importants principalement en tant qu'agents de désinfecture. Cependant, leur efficacité dépend de la température à laquelle nous l'utilisons comme agent de désactivation. Le chlorure de calcium peut empêcher la formation de glace de l'eau à des températures très basses, autour de -52 ° C. Mais le sel de roche fonctionne mieux vers 0 ° C.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le sel de roche
3. Qu'est-ce que le chlorure de calcium
4. Comparaison côte à côte - sel de roche vs chlorure de calcium sous forme tabulaire
5. Résumé
Qu'est-ce que le sel de roche?
Le sel de roche est un minéral naturel qui contient du chlorure de sodium. Par conséquent, la formule chimique est NaCl. Le nom minéralogique de ce minéral est Halite. Le sel de roche est le nom commun. En règle générale, ce minéral est incolore ou blanc. Mais, parfois, il peut avoir une couleur comme le bleu clair, le bleu foncé, le violet, le rose, le rouge, l'orange, le jaune ou le gris. Parce que cela est dû à la présence d'impuretés avec le chlorure de sodium.
Étant donné que la formule chimique de l'unité répétitive de l'halite est NaCl, la masse de formule est de 58.43 g / mol. Il a une structure cristalline cubique. Le minéral est fragile et la séquence minérale est blanche. Lorsque l'on considère l'occurrence de ce minéral, il existe dans de vastes lits d'évaporites sédimentaires. Ces évaporites créent en raison du séchage des lacs, des mers, etc.

Figure 01: Halite de couleur rose
L'utilisation la plus importante de ce sel est de gérer la glace. La saumure est une solution d'eau et de sel. Étant donné que la saumure a un point de congélation inférieur par rapport à l'eau pure, nous pouvons mettre de la saumure ou du sel de roche sur la glace (à 0 ° C). Cela fera fondre la glace. Par conséquent, dans les climats froids, les gens utilisent ce sel pour se propager dans leurs trottoirs et allées pour faire fondre la glace.
Qu'est-ce que le chlorure de calcium?
Le chlorure de calcium est un composé inorganique et un sel ayant la formule chimique CACL2. Il est incolore et cristallin qui se produit à un état solide à température ambiante. Il existe principalement comme un sel hydraté plutôt que comme le composé individuel. D'où la formule chimique précise est CACL2(H2O)X. Ici, x peut être 0, 1, 2, 4 ou 6. Ce sel est hygroscopique. Ainsi, nous pouvons l'utiliser comme dessicant.

Figure 02: Aspect du chlorure de calcium
La masse molaire du composé est 110.98 g / mol. Il a une structure cristalline orthorhombique dans sa forme anhydre et sa structure cristalline trigonale sous sa forme hexahydrate. Lorsque l'on considère l'occurrence de ce composé, elle se produit rarement dans la nature comme la sinjarite minérale (forme de dihydrate) ou l'antarciticite (forme hexahydrate). En règle générale, pour presque toutes les utilisations de ce composé, nous la produisons à partir de calcaire. Cela se forme comme un sous-produit du processus Solvay. Ou bien, nous pouvons l'obtenir de la purification de la saumure.
Ici aussi, la principale application de ce composé est en désactivation. Il peut empêcher la formation de glace en déprimant le point de congélation de l'eau. Surtout, ce composé est beaucoup plus efficace à des températures plus basses en tant qu'agent de désactivation.
Quelle est la différence entre le sel rocheux et le chlorure de calcium?
Le sel de roche est un minéral naturel qui contient du chlorure de sodium tandis que le chlorure de calcium est un composé inorganique et un sel ayant la formule chimique cacl2. Chimiquement, c'est la différence entre le sel rocheux et le chlorure de calcium. Étant donné que ces deux matériaux ont une composition chimique différente, la masse molaire est également différente les unes des autres: la masse de formule de sel de roche est de 58.43 g / mol tandis que la masse molaire du chlorure de calcium est 110.98 g / mol. Par conséquent, sur la base des propriétés, il s'agit d'une différence significative entre le sel de roche et le chlorure de calcium.
Lorsque vous envisagez les applications, ces deux composés sont importants principalement dans la gestion de la glace. Par conséquent, la principale différence entre le sel roche.
L'infographie ci-dessous donne plus de détails sur la différence entre le sel rocheux et le chlorure de calcium.
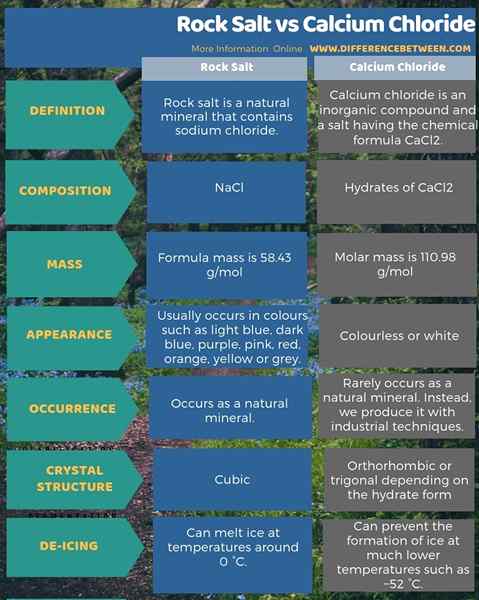
Résumé - Salt de roche vs chlorure de calcium
Le sel rocheux et le chlorure de calcium sont importants pour gérer la formation de glace. Pourtant, leur efficacité se diffère en fonction de la température. Par conséquent, la principale différence entre le sel rocheux et le chlorure de calcium est qu'en tant qu'agents de désincarner, le chlorure de calcium est très efficace à des températures plus basses que l'efficacité du sel de roche à la même température à basse température.
Référence:
1. «Halite.»Wikipedia, Wikimedia Foundation, 17 octobre. 2018. Disponible ici
2. "Chlorure de calcium.»Wikipedia, Wikimedia Foundation, 1er octobre. 2018. Disponible ici
Image gracieuseté:
1."Halite-nahcolite-60710" par Rob Lavinsky, (CC By-Sa 3.0) via Commons Wikimedia
2."Chlorure de calcium CACL2" sans auteur lisible par machine fourni. (CC BY-SA 3.0) via Commons Wikimedia


