Différence entre phényl et benzyl

Phényle vs benzyl
Le phényl et le benzyl sont dérivés du benzène et généralement confus par les étudiants en chimie. Le phényle est une molécule d'hydrocarbure avec la formule C6H5, tandis que le benzyl est c6H5Ch2; Un ch2 groupe attaché à l'anneau de benzène.
Phényle
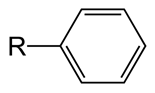
Le phényle est une molécule d'hydrocarbure avec la formule C6H5. Ceci est dérivé du benzène, par conséquent, a des propriétés similaires à celle du benzène. Cependant, cela diffère du benzène en raison de l'absence d'atome d'hydrogène dans un carbone. Le poids moléculaire du phényle est donc de 77 g de mol-1. Le phényle est abrégé sous forme de pH. Habituellement, le phényle est attaché à un autre groupe phényle, atome ou molécule (cette partie est connue sous le nom de substituant du groupe R comme sur la figure). Les atomes de carbone du phényle sont hybridés SP2 comme dans le benzène. Tous les carbones peuvent former trois obligations sigma. Deux des liaisons Sigma sont formées avec deux carbones adjacents, de sorte qu'il donne naissance à une structure d'anneau. L'autre liaison sigma est formée avec un atome d'hydrogène. Cependant, dans un carbone, dans l'anneau, la troisième liaison Sigma est formée avec un autre atome ou molécule plutôt qu'un atome d'hydrogène. Les électrons en orbitales P se chevauchent pour former le nuage d'électrons délocalisé. Par conséquent, le phényl a des longueurs de liaisons C-C similaires entre tous les carbones, indépendamment des liaisons simples et doubles alternées. Cette longueur de liaison C-C est d'environ 1.4 Å. L'anneau est planaire et a un angle de 120 ° entre les liaisons autour d'un carbone. En raison du groupe substituant de phényle, la polarité et d'autres propriétés chimiques ou physiques changent. Si le substituant donne des électrons au nuage d'électrons délocalisé de l'anneau, ceux-ci sont appelés groupes de don d'électrons (e.g. -Och3, NH2). Si le substituant attire les électrons du nuage d'électrons, il est connu sous le nom de substituant de retrait d'électrons. (E.g. -NON2, -COOH). Les groupes phényles sont stables en raison de leur aromaticité, ils ne subissent donc pas facilement d'oxydations ou de réductions. De plus, ils sont hydrophobes et non polaires.
Benzyl
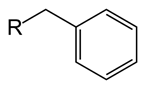
La formule du benzyl est c6H5Ch2. C'est aussi un dérivé du benzène. Par rapport au phényl, le benzyl a un ch2 groupe attaché à l'anneau de benzène. Une autre partie moléculaire (groupe R tel que représenté sur l'image) peut être attachée au groupe benzylique via une liaison au CH2 atome de carbone. Le groupe benzyle est abrégé comme «BN». Le poids moléculaire du groupe benzylique est de 91 g de mol-1. Puisqu'il y a un anneau de benzène, le groupe benzyle est aromatique. Dans les mécanismes de chimie organique, le groupe benzyle peut être formé soit comme radical, carbocation (c6H5Ch2+) ou un carboanion (c6H5Ch2-). Par exemple, dans les réactions de substitution nucléophile, un radical benzylique ou un intermédiaire cation. Il y a une stabilisation plus élevée de ces intermédiaires par rapport au radical alkyle ou au cation. La réactivité de la position benzylique est similaire à celle de la position allylique. Les groupes benzyles sont souvent utilisés dans la chimie organique comme groupes de protection, en particulier pour protéger les groupes fonctionnels de l'acide carboxylique ou de l'alcool.
Quelle est la différence entre le phényl et le benzyl?
• La formule moléculaire du phényle est C6H5 Alors que, dans le benzyl, c'est C6H5Ch2.
• Benzyl a un ch2 groupe par rapport au phényle.
• En phényle, le cycle benzène est directement attaché à une molécule de substituant ou à un atome, mais en benzyle, le ch2 Le groupe établit le lien avec une autre molécule ou un atome.


