Différence entre l'azote et le nitrate
Le différence clé entre l'azote et le nitrate est que L'azote est un élément, tandis que le nitrate est un composé d'azote et d'oxygène.
Les nitrates sont des formes anioniques hautement disponibles contenant de l'azote. Naturellement, l'azote existe sous forme de gaz, et c'est le principal réservoir d'azote. Les plantes ne peuvent pas utiliser directement cet azote gazeux, donc certaines bactéries ont tendance à convertir l'azote gazeux en formes solubles dans l'eau comme les nitrates, les nitrites ou l'ammonium. L'azote atmosphérique est converti en nitrate par fixation industrielle, de l'action de la foudre et par certains micro-organismes du sol. Nous appelons ce processus Fixation d'azote. L'ammoniac et les nitrites peuvent également être convertis en nitrate par les bactéries nitrifiantes dans le sol. Les nitrates dans le sol sont ensuite absorbés par les plantes pour leurs activités. De plus, les nitrates du sol peuvent se transformer en azote gazeux par les bactéries dénitrifiantes comme Thiobacillus dénitrificans.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'azote
3. Qu'est-ce que le nitrate
4. Comparaison côte à côte - azote vs nitrate sous forme tabulaire
5. Résumé
Qu'est-ce que l'azote?
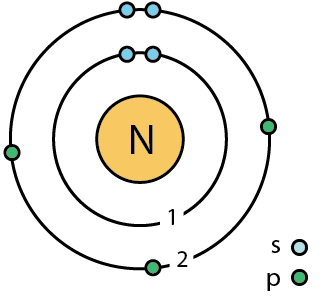
L'azote est le quatrième élément le plus abondant de notre corps. Il se trouve dans le groupe 15 du tableau périodique avec le numéro atomique 7. L'azote est un non-métal et sa configuration électronique est 1S2 2S2 2P3. L'orbital P est à moitié rempli, donnant à l'azote la capacité de prendre trois électrons supplémentaires afin d'atteindre la configuration stable de gaz noble. Par conséquent, l'azote est trivalent.

Figure 01: Atome d'azote
Deux atomes d'azote peuvent former une triple liaison entre eux, partageant trois électrons. Cette molécule diatomique est en phase gazeuse à température ambiante et forme un gaz inerte incolore, inodore et insipide. L'azote est un gaz non inflammable et ne supporte pas la combustion. C'est le gaz le plus abondant de l'atmosphère terrestre (environ 78%).
Naturellement, il y a deux isotopes d'azote, N-14 et N-15. N-14 est plus abondant. À très basses températures, l'azote va à l'état liquide. Il est similaire à l'eau en apparence, mais la densité est inférieure à celle de l'eau.
L'azote est largement utile dans les industries chimiques et est une composante vitale nécessaire aux organismes vivants. L'utilisation commerciale la plus importante de l'azote est son utilisation comme matière première pour l'ammoniac, l'acide nitrique, l'urée et d'autres composés d'azote. Ces composés peuvent être incorporés dans des engrais car l'azote est l'un de ses principaux éléments dont les usines ont besoin pour leur croissance. L'azote est également important dans des endroits où nous avons besoin d'un environnement inerte, en particulier lorsque vous effectuez des réactions chimiques. De plus, l'azote liquide est important pour geler les choses instantanément et en tant que liquide de refroidissement dans divers appareils (E.g.: des ordinateurs).
Qu'est-ce que le nitrate?
Le nitrate est un anion polyatomique contenant de l'azote et trois atomes d'oxygène. L'atome d'azote est à l'état d'oxydation +5. La géométrie de cette molécule est planaire trigonale, et elle montre également une résonance. Cet anion monovalent peut se joindre à tout autre type de cation pour former divers composés organiques et inorganiques.
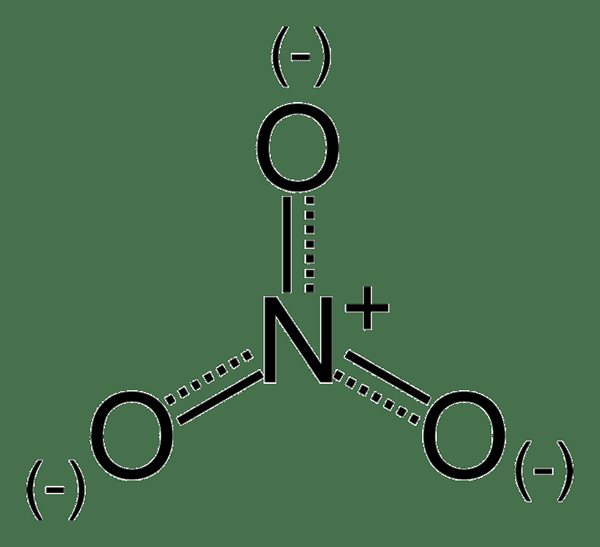
Figure 02: Structure stabilisée par résonance de l'anion nitrate
Les composés contenant du nitrate sont souvent solubles dans l'eau et de nature abondante dans le sol, l'eau et la nourriture. Les nitrates sont principalement importants pour faire des engrais. Ils sont également importants pour faire des explosifs. Les nitrates sont relativement non toxiques. À l'intérieur de notre corps, les nitrates se convertissent en nitrites et donc, il peut devenir toxique.
Quelle est la différence entre l'azote et le nitrate?
Bien que les termes azote et nitrate semblent similaires, ce sont des termes très différents. La principale différence entre l'azote et le nitrate est que l'azote est un élément, tandis que le nitrate est un composé d'azote et d'oxygène. En d'autres termes, l'azote est l'élément chimique ayant le numéro atomique 7 et le symbole n tandis que le nitrate est un anion ayant la formule chimique no3-. De plus, l'atome d'azote est trivalent tandis que l'anion nitrate est monovalent. Lorsque vous envisagez la charge, l'atome d'azote libre est neutre tandis que l'anion nitrate a -1 charge. De plus, l'état d'oxydation de l'atome d'azote libre est nul mais dans l'anion nitrate, c'est +5.

Résumé - azote vs nitrate
L'azote est l'élément chimique ayant le numéro 7 atomique et le symbole N et le nitrate est un anion ayant la formule chimique NO3-. La principale différence entre l'azote et le nitrate est que l'azote est un élément, tandis que le nitrate est un composé d'azote et d'oxygène.
Référence:
1. Powlson, D.s., et T.m. Addiscott. «Azote dans les sols | Nitrates.»Encyclopédie des sols dans l'environnement, 2005, pp. 21-31., doi: 10.1016 / B0-12-348530-4 / 00905-X.
Image gracieuseté:
1. «7 azote (N) Modèle Bohr» par Ahazard.ScienceWriter - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Nitrate-ion» par Benjah-Bmm27 - Propre travaux (domaine public) via Commons Wikimedia


