Différence entre le solide moléculaire et le réseau covalent solide
Le différence clé entre le solide moléculaire et le solide du réseau covalent est que formes solides moléculaires dues à l'action des forces de van der Waal tandis que le réseau covalent se formes solides en raison de l'action des liaisons chimiques covalentes.
Nous pouvons classer les composés solides de différentes manières - en fonction de la structure, de la composition, de la liaison, des propriétés, des applications, etc. Solides moléculaires, solides ioniques, solides métalliques, solides de réseau covalent sont des types de solides si différents.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le solide moléculaire
3. Qu'est-ce que le réseau covalent solide
4. Comparaison côte à côte - solide moléculaire vs réseau covalent solide sous forme tabulaire
5. Résumé
Qu'est-ce que le solide moléculaire?
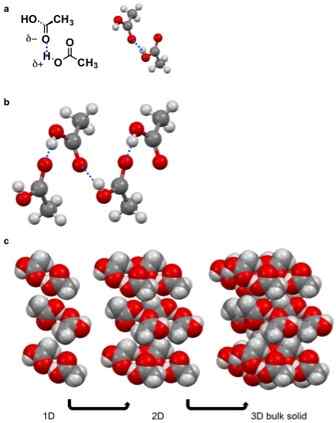
Un solide moléculaire est un composé solide contenant des molécules maintenues ensemble via Van der Waal Forces. Il n'y a pas de liaisons ioniques ou covalentes entre ces molécules. Les forces entre ces molécules sont des forces d'attraction cohésives. Il existe différents types de forces van der Waal qui peuvent provoquer la formation d'un solide moléculaire, i.e. Interactions dipol-dipole, interactions PI-PI, liaison hydrogène, forces londoniennes, etc.

Figure 01: Formation de solides moléculaires dus à la liaison hydrogène
Cependant, ces forces de van der Waal sont plus faibles par rapport aux liaisons chimiques ioniques et covalentes. Par conséquent, les solides moléculaires ont généralement des points de fusion et d'ébullition relativement faibles. De plus, ces solides ont tendance à se dissoudre dans des solvants organiques. Ces solides moléculaires ont une faible densité et sont également non conducteurs; Ainsi, ce sont des isolants électriques doux.

Figure 02: Le dioxyde de carbone solide et la caféine solide sont des solides moléculaires
De plus, lorsque l'on considère les différents allotropes d'un élément chimique, tous les allotropes existent parfois sous forme de solides moléculaires, mais la plupart du temps, certains allotropes sont des solides moléculaires tandis que d'autres allotropes du même élément chimique ne sont pas des solides moléculaires. Par exemple, il existe différentes formes allotropes de phosphore; Nous les nommons comme phosphore rouge, blanc et noir. Parmi eux, le phosphore blanc est un solide moléculaire, mais le phosphore rouge existe sous forme de structures de chaîne.
De plus, les solides moléculaires sont ductiles ou cassants en fonction de la nature des faces cristallines du solide. Ces deux formes ductiles et cassantes peuvent également subir une déformation élastique.
Qu'est-ce qu'un réseau covalent solide?
Les solides du réseau covalent sont des composés solides contenant des atomes liés les uns aux autres via des liaisons chimiques covalentes. Ces solides ont un certain nombre d'atomes répétitifs liés les uns aux autres via des liaisons covalentes. La liaison chimique peut provoquer la formation d'un réseau d'atomes, ce qui conduit à la formation d'un réseau solide. Par conséquent, nous pouvons considérer un réseau covalent solide comme un type de macromolécule.
De plus, ces solides peuvent se produire de deux manières; Comme des solides cristallins ou des solides amorphes. Un exemple approprié pour un solide de réseau est le diamant avec des atomes de carbone à liaison covalente, qui forme une forte structure 3D. Habituellement, les solides du réseau covalent ont des points de fusion et d'ébullition relativement élevés. Généralement, ces solides sont insolubles dans tout type de solvant car il est très difficile de décomposer les liaisons entre les atomes. De plus, ces solides sont très durs et ont une faible conductivité électrique à sa phase liquide. La conductivité électrique à la phase solide peut varier en fonction de la composition.
Quelle est la différence entre le solide moléculaire et le réseau covalent solide?
Les solides moléculaires et les solides du réseau covalent sont deux types de composés solides. La principale différence entre le solide moléculaire et le solide du réseau covalent est que les formes solides moléculaires dues à l'action des forces van der Waal tandis que les formes solides du réseau covalent en raison de l'action des liaisons chimiques covalentes. Lorsque vous envisagez leurs propriétés, les solides moléculaires sont un matériau relativement doux, tandis que les solides du réseau covalent sont très durs.
De plus, les solides moléculaires ont des points de fusion relativement faibles, tandis que les solides du réseau covalent ont des points de fusion très élevés. De plus, les solides moléculaires sont des isolateurs électriques, tandis que les solides du réseau covalent ont une faible conductivité électrique à l'état liquide et la conductivité électrique à la phase solide peut varier en fonction de la composition. La glace d'eau est un bon exemple pour les solides moléculaires, tandis que le diamant est le meilleur exemple de réseau covalent solide.
En dessous de l'infographie résume la différence entre le solide moléculaire et le réseau covalent solide.
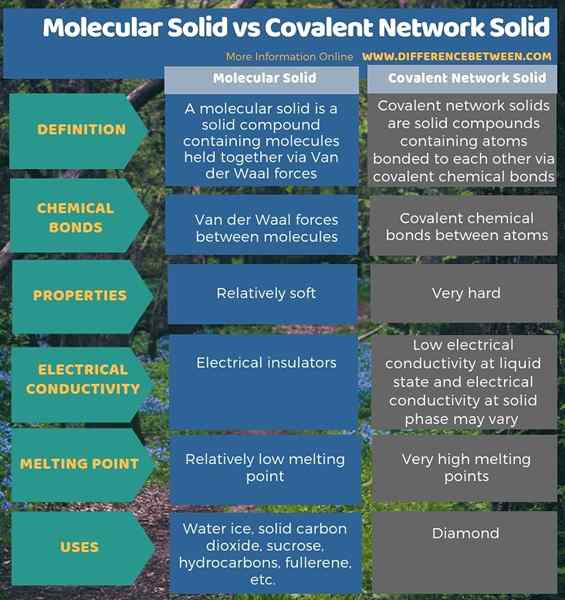
Résumé - Solide moléculaire vs réseau covalent solide
Les solides moléculaires et les solides du réseau covalent sont deux types de composés solides. La principale différence entre le solide moléculaire et le solide du réseau covalent est que les formes solides moléculaires dues à l'action des forces van der Waal tandis que les formes solides du réseau covalent en raison de l'action des liaisons chimiques covalentes.
Référence:
1. Helmenstine, Anne Marie. «Solides moléculaires: définition et exemples.”Thoughtco, dec. 3, 2018, disponible ici.
2. Helmenstine, Anne Marie. «Définition solide du réseau en chimie."Thoughtco, juil. 8, 2019, disponible ici.
Image gracieuseté:
1. «Liaison hydrogène acide acétique» par Cryst Eng 340 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «Dioxyde de carbone et caféine» par Cryst Eng 340 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


