Différence entre le chlorure de magnésium et le sulfate de magnésium

Le différence clé entre le chlorure de magnésium et le sulfate de magnésium est que La molécule de chlorure de magnésium a un cation de magnésium associé à deux anions de chlorure tandis que la molécule de sulfate de magnésium a un cation de magnésium associé à un anion sulfate.
Le magnésium est un métal de terre alcalin qui peut former un cation stable divalent. Ce cation peut former de nombreux composés ioniques tels que le chlorure de magnésium et le sulfate de magnésium. Ce sont des composés solides à température ambiante qui peuvent exister sous différentes formes hydratées. Cet article traite de plus de détails sur ces deux composés et autres différences entre eux.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlorure de magnésium
3. Qu'est-ce que le sulfate de magnésium
4. Comparaison côte à côte - chlorure de magnésium vs sulfate de magnésium sous forme tabulaire
5. Résumé
Qu'est-ce que le chlorure de magnésium?
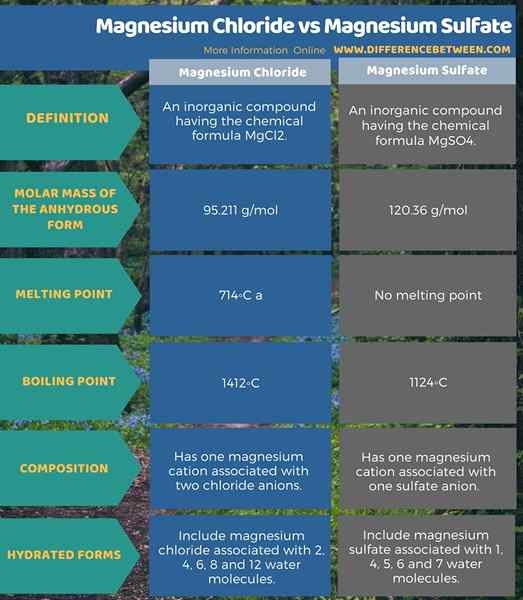
Le chlorure de magnésium est un composé inorganique ayant la formule chimique MGCL2. Il peut exister sous diverses formes d'hydrate. Ces composés sont des halogénures ioniques et sont fortement solubles dans l'eau. Nous pouvons obtenir les formes hydratées à partir de l'eau de mer via différentes extractions. La masse molaire de la forme anhydre est 95.211 g / mol. C'est un solide cristallin blanc à collant.

Figure 01: cristaux de chlorure de magnésium
Le point de fusion est de 714◦C, et le point d'ébullition est 1412◦C. La cristallisation de ce composé ressemble à la cristallisation du chlorure de cadmium. Il a des centres mg octaédriques. Les hydrates les plus courants comprennent le chlorure de magnésium associé à 2, 4, 6, 8 et 12 molécules d'eau.
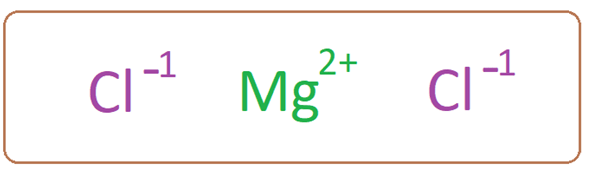
Le chlorure de magnésium a un cation de magnésium associé à deux anions chlorure
Nous pouvons produire ce composé via le processus Dow dans lequel l'hydroxyde de magnésium est traité avec de l'acide HCl pour obtenir du chlorure de magnésium et de l'eau.
Mg (oh)2 + HCL → MGCL2 + H2O
Les applications de ce composé comprennent la production de magnésium métal.
Qu'est-ce que le sulfate de magnésium?
Le sulfate de magnésium est un composé inorganique ayant la formule chimique MGSO4. C'est un sel de magnésium et peut exister sous plusieurs formes hydratées. La masse molaire de la forme anhydre est 120.36 g / mol. Il apparaît comme un solide cristallin blanc à température ambiante. Ce composé est inodore. Il n'a pas de point de fusion. Au lieu de cela, il se décompose à 1124◦C.

Figure 02: sulfate de magnésium anhydre
Contrairement au sulfate de magnésium, ce composé n'est pas beaucoup d'eau soluble. Les formes hydratées comprennent le sulfate de magnésium associé à 1, 4, 5, 6 et 7 molécules d'eau.
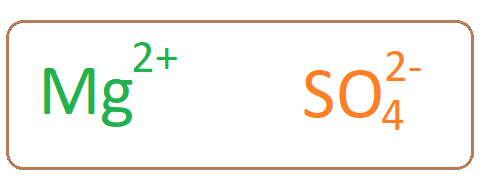
La molécule de sulfate de magnésium a un cation de magnésium associé à un anion sulfate
Les applications de ce composé sont dans le domaine de la médecine en tant que minéral pour la production pharmaceutique de magnésium, la pâte de ce composé est utile pour traiter les inflammations cutanées, etc. De plus, il est utile dans l'agriculture pour augmenter les niveaux de magnésium et de soufre dans le sol.
Quelle est la différence entre le chlorure de magnésium et le sulfate de magnésium?
Compte tenu de la structure moléculaire des deux, la molécule de chlorure de magnésium a un cation de magnésium associé à deux anions de chlorure tandis que la molécule de sulfate de magnésium a un cation magnésium associé à un anion au sulfate. C'est la principale différence entre le chlorure de magnésium et le sulfate de magnésium.
De plus, le chlorure de magnésium est un composé inorganique ayant la formule chimique MGCL2. La masse molaire de la forme anhydre est 95.211 g / mol. De plus, les hydrates les plus courants comprennent le chlorure de magnésium associé à 2, 4, 6, 8 et 12 molécules d'eau. Le sulfate de magnésium est un composé inorganique ayant la formule chimique MGSO4. La masse molaire de la forme anhydre est 120.36 g / mol. De plus, les formes hydratées communes comprennent le sulfate de magnésium associé à des molécules d'eau 1, 4, 5, 6 et 7.
Résumé - chlorure de magnésium vs sulfate de magnésium
Le magnésium est un élément chimique du groupe 2 qui peut former des cations divalents stables qui sont capables de former des composés ioniques. Le chlorure de magnésium est un halogénure ionique et le sulfate de magnésium est un sel de magnésium. La différence entre le chlorure de magnésium et le sulfate de magnésium est que la molécule de chlorure de magnésium a un cation de magnésium associé à deux anions de chlorure tandis que la molécule de sulfate de magnésium a un cation de magnésium associé à un anion au sulfate.
Référence:
1. "Chlorure de magnesium.»Wikipedia, Wikimedia Foundation, 19 juin 2018.Disponible ici
2. "Sulfate de magnésium.»Wikipedia, Wikimedia Foundation, 19 juin 2018. Disponible ici
Image gracieuseté:
1.`` Chlorure de magnésium '' (domaine public) via les communes Wikimedia
2.«Sulfate de magnésium anhydre» (domaine public) via Commons Wikimedia


