Différence entre les métaux du groupe 1 et les métaux de transition
Le différence clé entre les métaux du groupe 1 et les métaux de transition est que Les métaux du groupe 1 forment des composés incolores, tandis que les métaux de transition forment des composés colorés.
Les métaux du groupe 1 sont également connus sous le nom de métaux alcalins car ces éléments peuvent former des composés alcalins. Cependant, le groupe 1 du tableau périodique contient de l'hydrogène, qui est un non-métal. Les métaux de transition, en revanche, sont des éléments de bloc D, mais tous les éléments de blocs D ne sont pas des métaux de transition. Les métaux du groupe 1 et les métaux de transition sont similaires dans le fait que les deux ont des électrons non appariés.
CONTENU
1. Aperçu et différence clé
2. Que sont les métaux du groupe 1
3. Que sont les métaux de transition
4. Comparaison côte à côte - Métaux du groupe 1 vs métaux de transition sous forme tabulaire
5. Résumé
Que sont les métaux du groupe 1?
Les métaux du groupe 1 sont des éléments chimiques ayant un électron non apparié dans l'orbitale Ster la plus externe. Ces métaux sont nommés métaux alcalins car ils forment des composés chimiques qui sont alcalins lorsqu'ils sont dissous dans l'eau. Nous pouvons observer ces éléments dans la première colonne du bloc S du tableau périodique. Les membres de ces métaux du groupe 1 sont les suivants:
- Lithium (li)
- Sodium (NA)
- Potassium (k)
- Rubidium (RH)
- Césium (CS)
- Francium (FR)
Les métaux du groupe 1 sont tous brillants, hautement réactifs et très doux (nous pouvons facilement les couper en utilisant un couteau simple). Généralement, les métaux de ce groupe présentent de faibles densités, de faibles points de fusion, de faibles points d'ébullition et ont des structures cristallines cubiques axées sur le corps. De plus, ils ont des couleurs de flamme distinctes, nous pouvons donc facilement les distinguer en exposant un échantillon à un brûleur Bunsen.
De plus, il existe des variations périodiques entre les métaux du groupe 1. Par exemple, lorsque vous descendez le groupe, la taille atomique des éléments augmente, le point de fusion et le point d'ébullition diminuent, la densité augmente, la première énergie d'ionisation augmente, la réactivité diminue, etc.
Que sont les métaux de transition?
Les métaux de transition sont des éléments chimiques ayant des atomes avec des électrons D non appariés. Dans ces éléments, au moins les cations stables qu'ils forment devraient avoir des électrons D non appariés. Ainsi, la plupart des éléments de blocs D sont des métaux de transition. Nous ne pouvons pas considérer le scandium et le zinc comme des métaux de transition car ils n'ont pas d'électrons non appariés même dans leurs cations stables. Ces atomes ont des électrons D, mais tous sont des électrons jumelés.

De plus, les éléments métalliques de transition peuvent former différents composés avec une variété de couleurs. Ces éléments obtiennent cette capacité en raison du fait que ces éléments peuvent avoir différents états d'oxydation qui sont très colorés. Ces différents états d'oxydation de l'élément chimique peuvent avoir des couleurs différentes. De plus, ces couleurs surgissent en raison des transitions électroniques D-D. De plus, en raison de la présence de ces électrons non appariés, ces métaux sont paramagnétiques ou ferromagnétiques. Presque tous ces éléments peuvent être liés aux ligands pour former des complexes de coordination.
Quelle est la différence entre les métaux du groupe 1 et les métaux de transition?
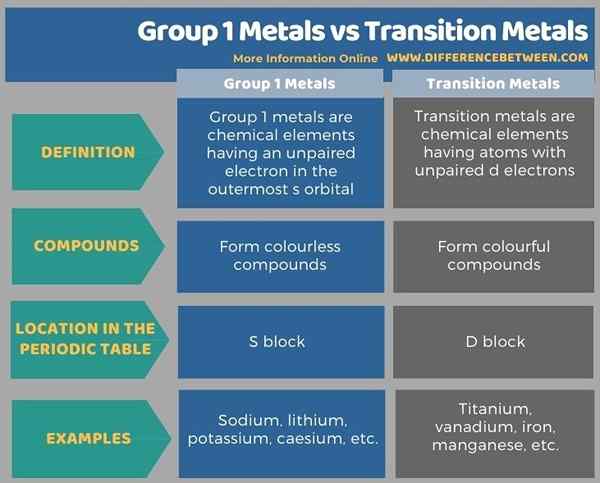
Les métaux du groupe 1 et les métaux de transition sont différents les uns des autres, principalement basés sur la couleur des composés chimiques qu'ils forment. C'est-à-dire; La principale différence entre les métaux du groupe 1 et les métaux de transition est que les métaux du groupe 1 forment des composés incolores, tandis que les métaux de transition forment des composés colorés.
De plus, les métaux du groupe 1 sont des éléments chimiques ayant un électron non apparié dans l'orbitale S à l'extérieur tandis que les métaux de transition sont des éléments chimiques ayant des atomes avec des électrons D non appariés.
Ci-dessous, l'infographie tabule les différences entre les métaux du groupe 1 et les métaux de transition plus en détail.
Résumé - Métaux du groupe 1 vs métaux de transition
Les métaux du groupe 1 et les métaux de transition sont différents les uns des autres, principalement basés sur la couleur des composés chimiques qu'ils forment. La principale différence entre les métaux du groupe 1 et les métaux de transition est que les métaux du groupe 1 forment des composés incolores, tandis que les métaux de transition forment des composés colorés.
Référence:
1. Coton, F. Albert. "Métal de transition.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 avril. 2019, disponible ici.
Image gracieuseté:
1. «Tableau de table périodique avec des non-métaux réactifs» par SandBH - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. Par Benjah-Bmm27 supposé (basé sur les réclamations du droit d'auteur). - Propre travail assumé (sur la base des réclamations du droit d'auteur)., (Domaine public) via Commons Wikimedia


