Différence entre la loi sur les taux différentiels et la loi sur les taux intégrés
Différence clé - Loi sur les taux différentiels vs loi sur les taux intégrés
La loi sur les taux différentiels et la loi intégrée sur les taux sont deux formes de lois sur les taux. La principale différence entre la loi sur les taux différentiels et la loi intégrée sur les taux est que La loi sur la vitesse différentielle donne le taux d'une réaction chimique en fonction de la variation de la concentration d'un ou plusieurs réactifs au cours d'une période particulière tandis que la loi de vitesse intégrée donne le taux d'une réaction chimique en fonction de la concentration initiale d'un ou plusieurs réactifs après une période de temps spécifique.
La vitesse de réaction est la mesure du changement de concentration de réactifs ou de produits pendant la progression d'une réaction chimique. Différentes lois sur les taux sont utilisées pour expliquer les progrès de la réaction. Ces lois sur les taux sont exprimées en relations mathématiques entre différents paramètres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la loi sur les taux différentiels
3. Qu'est-ce que la loi sur les taux intégrés
4. Relation entre la loi sur les taux différentiels et la loi intégrée
5. Comparaison côte à côte - Loi sur les taux différentiels vs loi de taux intégrée sous forme tabulaire
6. Résumé
Qu'est-ce que la loi sur les taux différentiels?
La loi sur la vitesse différentielle est utilisée pour déterminer la vitesse d'une réaction chimique en fonction du changement de concentration d'un ou plusieurs réactifs pendant une période de temps particulière. La loi sur la vitesse différentielle indique ce qui se passe au niveau moléculaire d'une réaction chimique. Le mécanisme global d'une réaction chimique peut être déterminé en utilisant des lois sur les taux différentiels (conversion des réactifs en produits).
Équation de la loi sur les taux différentiels
La loi sur la vitesse différentielle pour la réaction chimique ci-dessous peut être donnée comme une expression mathématique.
A → B + C
Rate = - d [a] / dt = k [a]n
Ici, [a] est la concentration de réactif «a» et «k» est la constante de vitesse. «N» donne l'ordre de réaction. L'équation de la loi sur le taux différentiel peut être intégrée pour obtenir une relation claire entre [a] et le temps «t». Cette intégration donne la loi sur les taux intégrés.

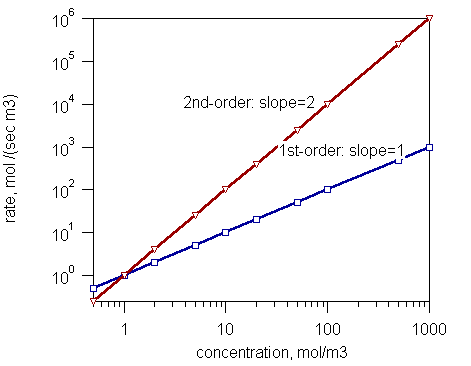
Figure 1: Un graphique montrant l'ordre de réaction
Qu'est-ce que la loi sur les taux intégrés?
La loi de taux intégrée donne le taux d'une réaction chimique en fonction de la concentration initiale d'un ou plusieurs réactifs après une période de temps spécifique. La loi de vitesse intégrée peut être utilisée pour déterminer la constante de vitesse d'une réaction chimique particulière, et l'ordre de réaction peut être obtenu via des données expérimentales.
Équation intégrée de la loi sur les taux
Pour la réaction chimique A → B + C, la loi de vitesse intégrée peut être exprimée comme une expression mathématique comme indiqué ci-dessous.
ln [a] = -kt + ln [a]0
Voici un]0 La concentration initiale du réactif A et [A] est la concentration de réactif «a» après le temps de «t». Cependant, les lois sur les taux intégrées sont différentes les unes des autres en fonction de l'ordre de la réaction «n». L'équation ci-dessus est donnée pour les réactions chimiques d'ordre zéro.
Pour Réactions de premier ordre, L'équation de la loi sur les taux est,
[A] = [a] e-kt
Pour réactions de second ordre, L'équation de la loi sur les taux est,
1 / [a] = 1 / [a]0 + kt
Afin de déterminer le Constante de vitesse d'une réaction, Les équations ci-dessus peuvent être utilisées comme suit.
Pour les réactions de premier ordre,
k = ln [a] - ln [a]0 / t
Pour les réactions du second ordre,
k = 1 / [a] - 1 / [a]0 / t
Quelle est la relation entre la loi sur les taux différentiels et la loi sur les taux intégrés?
- La loi sur la vitesse différentielle d'une réaction chimique peut être intégrée pour obtenir la loi de vitesse intégrée de la même réaction chimique.
Quelle est la différence entre la loi sur les taux différentiels et la loi sur les taux intégrés?
Loi sur les taux différentiels vs loi sur les taux intégrés | |
| La loi sur la vitesse différentielle est utilisée pour déterminer la vitesse d'une réaction chimique en fonction du changement de concentration d'un ou plusieurs réactifs pendant une période particulière. | La loi de taux intégrée donne le taux d'une réaction chimique en fonction de la concentration initiale (ou de la concentration à un moment particulier) d'un ou plusieurs réactifs après une période de temps spécifique. |
| Application | |
| La loi sur la vitesse différentielle peut être utilisée pour indiquer ce qui se passe au niveau moléculaire d'une réaction chimique et le mécanisme global d'une réaction chimique peut être déterminé en utilisant cette loi de vitesse. | La loi de taux intégrée peut être utilisée pour déterminer la constante de vitesse d'une réaction chimique particulière. |
| Usage | |
| La loi sur les taux différentiels est difficile à utiliser par rapport à la loi sur les taux intégrés. | La loi intégrée facilite la détermination de la relation claire entre la concentration des réactifs et le temps écoulé. |
Résumé - Loi sur les taux différentiels vs loi sur les taux intégrés
La loi sur la vitesse d'une réaction chimique donne la relation entre la vitesse de réaction et les concentrations de réactifs. La principale différence entre la loi sur les taux différentiels et la loi sur les taux intégrés est que la loi sur la vitesse différentielle donne le taux d'une réaction chimique en fonction de la variation de la concentration d'un ou plusieurs réactifs pendant une période de temps particulière tandis que la loi de taux intégrée donne le taux de rythme de une réaction chimique en fonction de la concentration initiale d'un ou plusieurs réactifs après une période de temps spécifique.
Référence:
1. «Lois de taux - différentiel.”Chemistry LibreTexts, LibreTexts, 17 juillet 2015, disponible ici.
2. LibreTexts. «12.4: lois sur les taux intégrés.”Chemistry LibreTexts, LibreTexts, 11 septembre. 2017, disponible ici.]]
Image gracieuseté:
1. «Rateloglogplot» de Fabiuccio ~ EnwikiBooks à l'anglais WikiBooks - transféré de EN.WikiBooks aux communes.(Domaine public) via Commons Wikimedia


