Différence entre la liaison Dπ-Dπ et la liaison delta
Le différence clé Entre la liaison Dπ-dπ et la liaison delta est que Les formes de liaison dπ-dπ entre une orbitale atomique d remplie et une orbitale atomique d vide tandis que la liaison delta se forme entre quatre lobes d'une orbitale atomique impliquée et quatre lobes d'une autre orbitale atomique impliquée.
Bond Dπ-Dπ et formes de liaison delta via le chevauchement des orbitales atomiques. Le chevauchement des orbitales dans la formation de liaisons Dπ-dπ crée une liaison coordonnée tandis que le chevauchement dans la formation de liaisons delta forme une liaison chimique covalente.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la liaison Dπ-dπ
3. Qu'est-ce que Delta Bond
4. Comparaison côte à côte - liaison dπ-dπ vs liaison delta sous forme tabulaire
5. Résumé
Qu'est-ce que la liaison Dπ-dπ?
Une liaison Dπ-Dπ est un type de liaison chimique covalente où un métal se lie à un ligand à travers le chevauchement de leurs orbitales D. En d'autres termes, ce type de liaisons chimiques covalents se forme lorsque l'orbital d rempli du métal de transition donne certains de ses électrons aux orbitales vides d'un ligand pour former des liaisons chimiques de coordination. Par conséquent, ces composés chimiques sont nommés complexes de coordination.
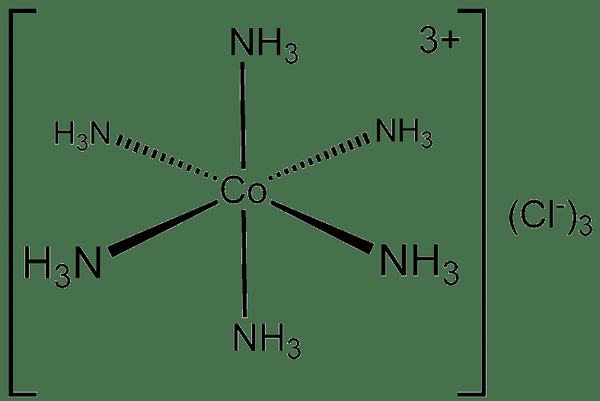
Figure 01: un composé covalent de coordonnées
Contrairement aux liaisons delta, qui ressemblent à la structure d'une liaison dπ-dπ, une liaison Dπ-dπ se produit entre une orbitale d remplie et une orbitale d vide. De plus, une liaison delta peut se produire entre deux atomes ayant impliqué des orbitales atomiques tandis qu'une liaison Dπ-dπ se produit entre un métal de transition ayant terminé la configuration d'électrons D et un ligand ayant des orbitales vides dans D en d coquille d'électrons.
Qu'est-ce qu'un lien delta?
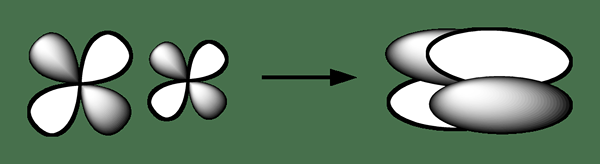
Delta Bond est un type de liaison chimique où quatre lobes d'une orbite atomique impliquée ont tendance à chevaucher avec quatre lobes d'une autre orbitale atomique impliquée pour former cette liaison. Ce type de chevauchement orbital conduit à la formation d'une orbitale moléculaire (liaison) qui est composée de deux plans nodaux contenant l'axe internucléaire, et qui passe par les deux atomes. La lettre grecque pour le panneau delta «» est utilisée pour la notation d'une obligation delta.

Figure 02: Formation d'une liaison chimique delta
Généralement, la symétrie orbitale de la liaison delta est similaire au type habituel d'orbital atomique d lors de l'examen de l'axe de la liaison. Nous pouvons observer ce type de liaison chimique dans les atomes ayant occupé des orbitales atomiques D qui contient une faible énergie pour participer à une liaison chimique covalente. Par exemple, les métaux de transition qui se trouvent dans les espèces chimiques organométalliques présentent une liaison delta; Les composés chimiques de certains métaux tels que le rhénium, le molybdène et le chrome contiennent des liaisons quadruples. Une obligation quadruple se compose d'une obligation Sigma, de deux obligations PI et d'une obligation delta.
Lorsque l'on considère la symétrie orbitale d'une liaison delta, nous pouvons observer que la symétrie est différente de celle d'une orbite antibondante PI. Une orbitale antibondante pi contient un plan nodal composé de l'axe internucléaire et un autre plan nodal perpendiculaire à l'axe entre les atomes.
Le scientifique Robert Mulliken a introduit la notation delta en 1931. Il a d'abord identifié cette liaison en utilisant le composé chimique Octachlorodirhenate (III).
Quelle est la différence entre la liaison Dπ-dπ et la liaison delta?
La liaison Dπ-Dπ et la liaison delta sont deux types de liaisons chimiques covalentes. La principale différence entre la liaison Dπ-Dπ et la liaison delta est que la liaison Dπ-Dπ se forme entre une orbitale atomique d remplie et une orbitale atomique d vide tandis que la liaison delta se forme entre quatre lobes d'une orbitale atomique impliquée et quatre lobes d'une autre orbitale atomique impliquée impliquée impliquée impliquée.
Avant que l'infographie résume les différences entre la liaison Dπ-Dπ et la liaison delta sous forme tabulaire.
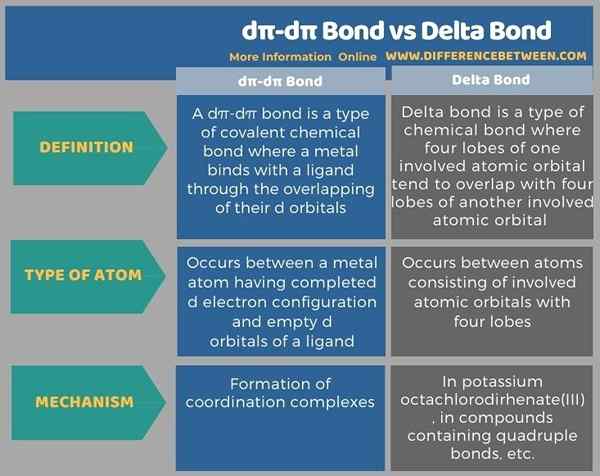
Résumé - Bond Dπ-dπ Vs Bond delta
La liaison Dπ-Dπ et la liaison delta sont deux types de liaisons chimiques covalentes. La principale différence entre la liaison Dπ-Dπ et la liaison delta est que la liaison Dπ-Dπ se forme entre une orbitale atomique d remplie et une orbitale atomique d vide tandis que la liaison delta se forme entre quatre lobes d'une orbitale atomique impliquée et quatre lobes d'une autre orbitale atomique impliquée impliquée impliquée impliquée.
Image gracieuseté:
1. «COA6CL3» - Smokefoot supposé - Aucune source lisible par machine fournie. Propre travail assumé (sur la base des réclamations du droit d'auteur). (Domaine public) via Commons Wikimedia
2. «Delta-Bond-formation-2d» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


