Différence entre le carbocation classique et non classique
La principale différence entre les carbocations classiques et non classiques est que Les carbocations classiques ont un atome de carbone ayant six électrons dans trois liaisons chimiques, tandis que les carbocations non classiques ont une structure à deux centres à deux centres.
Un carbocation est une espèce chimique qui est une fraction d'une molécule organique. Il a une charge positive sur un atome de carbone. Un exemple simple de carbocation est ch3+. Certaines carbocations ont plus d'une charge positive, sur le même atome de carbone ou un atome différent. De plus, les carbocations sont des intermédiaires réactifs dans les réactions organiques en raison de la présence d'une charge positive; Il y a six électrons dans un atome de carbone, ce qui le rend instable (la présence de huit électrons assure la stabilité); Par conséquent, il a tendance à chercher des électrons.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la carbocation classique
3. Qu'est-ce que le carbocation non classique
4. Comparaison côte à côte - carbocation classique vs non classique sous forme tabulaire
5. Résumé
Qu'est-ce que la carbocation classique?
Un carbocation classique est un ion contenant un atome de carbone chargé positivement qui a six électrons qui participent à trois liaisons chimiques. Nous pouvons nommer cet atome de carbone comme un carbone positif à trois coordonnées.
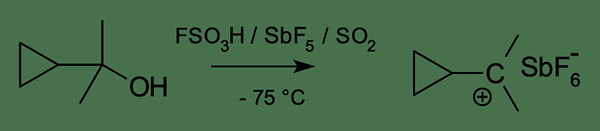
Figure 01: Formation d'un carbocation classique
Pour assurer une stabilité maximale, l'atome de carbone doit avoir huit électrons de valence. Mais dans le carbocation, il n'y a que six électrons dans l'atome de carbone ayant une charge positive. Par conséquent, il a tendance à partager deux autres électrons d'une espèce électronégative. Cela rend l'atome de carbone stable et neutralise la charge positive. C'est la raison de la forte réactivité des carbocations classiques. Cependant, l'énergie d'un carbocation classique est faible par rapport à l'énergie du carbocation non classique correspondant. Mais cette différence dans leurs énergies est très petite.
Qu'est-ce que le carbocation non classique?
Un carbocation non classique est un ion contenant un carbone chargé positivement dans un centre à deux centres à trois centres. Cela signifie qu'il y a trois atomes partageant deux électrons dans ces carbocations. Ce type de partage d'électrons est nommé délocalisation des électrons.

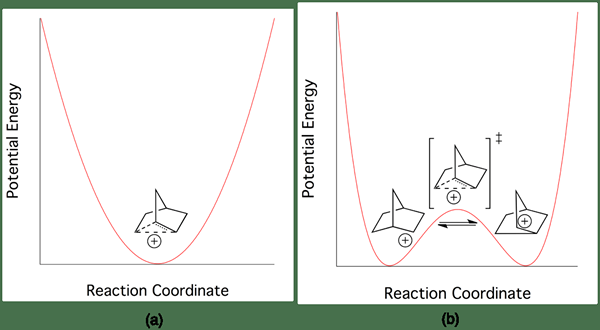
Figure 02: Différence d'énergie entre les carbocations classiques et non classiques
L'exemple le plus courant d'un carbocation non classique est le cation 2-norbornyle. Il existe dans une structure à deux centres à deux centimères moins symétrique. Il y a très peu de différence dans l'énergie entre les carbocations classiques et non classiques. Par conséquent, il est très difficile de les distinguer expérimentalement.
Quelle est la différence entre les carbocations classiques et non classiques?
Nous pouvons classer les carbocations en deux groupes en tant que carbocations classiques et non classiques, selon la structure chimique. La principale différence entre les carbocations classiques et non classiques est que les carbocations classiques ont un atome de carbone ayant six électrons dans trois liaisons chimiques, tandis que les carbocations non classiques ont une structure à deux centres à deux cents. L'énergie du carbocation non classique est plus élevée que l'énergie du carbocation classique, mais la différence entre ces énergies est très petite; Par conséquent, il est très difficile de distinguer la différence entre les structures classiques et non classiques.
De plus, l'énergie d'activation pour la conversion du carbocation classique en carbocation non classique ou vice versa est très petite. En plus de ceux-ci, les carbocations classiques ont la charge positive sur l'atome de carbone et les paires d'électrons NOD autour de l'atome de carbone, mais dans les carbocations non classiques, les électrons sont délocalisés autour de l'atome de carbone. Un exemple de carbocation classique est l'ion de méthénium, tandis qu'un exemple pour un carbocation non classique est l'ion à 2 norboryl.

Résumé - Carbocation classique vs non classique
Nous pouvons classer les carbocations en deux groupes en tant que carbocations classiques et non calculiques, selon la structure chimique. La principale différence entre les carbocations classiques et non classiques est que les carbocations classiques ont un atome de carbone ayant six électrons dans trois liaisons chimiques, tandis que les carbocations non classiques ont une structure à deux centres à deux cents. Un exemple de carbocation classique est l'ion de méthénium tandis qu'un exemple de carbocation non classique est à 2 norboryl ion.
Référence:
1. «Carbocations.”Chemistry LibreTexts, 5 juin 2019, disponible ici.
2. «Carbocation». Wikipédia.Org, 2019, disponible ici.
Image gracieuseté:
1. «Le cyclopropyl carbinyl cation» de v8rik à anglais wikipedia (cc by-sa 3.0) via Commons Wikimedia
2. «Norbornyl cation single bien vs double puits potentiel» par JCAL730 - propre travail (domaine public) via Commons Wikimedia


